
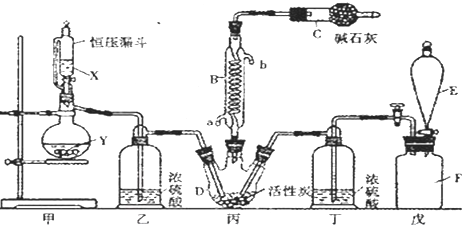
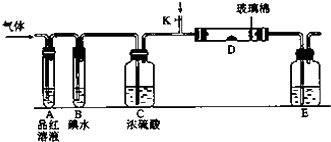
���� ����������װ�ã���װ���Ʊ����������������������ڱ��з�Ӧ����SO2Cl2�����л���̿������������ã�SO2Cl2��ˮ�������ҵ�ˮ�ⷴӦ����Ϊ�����������E��ʢ����Һ���������ų�װ���������������DZ���ʳ��ˮ�����������ܽ�ȣ�������������SO2Cl2�е�͡��ӷ���BΪ�����ܣ�ʹ�ӷ��IJ���SO2Cl2������������ʯ������Ϊ��Ӧ�Ķ���������������ֹ��Ⱦ�����������տ����е�ˮ��������ֹ����C�е��»�����ˮ�⣬�Դ˽����⣮
��� �⣺��1������װ��ͼ��֪��EΪ��Һ©���������������ܵ�������������������Ӧ��û�м��ȣ���SO2��������ķ�ӦΪ���ȷ�Ӧ������ˮ�½��ϳ���a�ڽ��룬�÷�Ӧ�Ƿ��ȷ�Ӧ�������¶���ʹƽ�������ƶ��������ڶ��Ȼ��������ɣ�
�ʴ�Ϊ����Һ©�����ţ�a���÷�Ӧ�Ƿ��ȷ�Ӧ�������¶���ʹƽ�������ƶ��������ڶ��Ȼ��������ɣ�
��2�������Ʊ�SO2��װ�ã�ͭ��Ũ���ᷴӦ��Ҫ���ȣ�����������SO2��ֻ��c����Ҫ�ʴ�Ϊ��c��
��3������ˮ�����ڱ���ʳ��ˮ����E�е��Լ��DZ���ʳ��ˮ��������ˮ���ڵ������¿ɽ�SO2���������ᣬ��������ԭΪHCl����Ӧ�ķ���ʽΪSO2+Cl2+2H2O=H2SO4+2HCl��
�ʴ�Ϊ������ʳ��ˮ��SO2+Cl2+2H2O=H2SO4+2HCl��
��4������������ж��Ȼ����������ٷֺ���Ϊx����
SO2Cl2��H2SO4��BaSO4
135 233
1.00g��x 1.5g
����135��233=1.00g��x��1.5g
���x=86.9%
�ʴ�Ϊ��86.9��
��5��SO2Cl2���ú�ֽ�������������������ܽ��������£�����Һ��ʻ�ɫ���ʴ�Ϊ����ΪSO2Cl2�����ֽ�����Cl2��Cl2����ʹҺ��ʻ�ɫ��
���� ���⿼��ʵ���Ʊ�������Ϊ�߿��������ͣ�������ѧ���ķ�����ʵ��ͼ��������Ŀ��飬��Ŀ�漰�Է�Ӧԭ����װ�ü������ķ������ۡ���������ʶ�����ʵķ����ᴿ�ȣ�ע�������������Ϣ��Ӧ�ã��Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ͨ��ʢ���Ը��������Һ��ϴ��ƿ | |
| B�� | �����ͨ��ʢ������ˮ��ϴ��ƿ | |
| C�� | �����ͨ��ʢˮ��ϴ��ƿ | |
| D�� | ��������Ȼ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| �¶� | ʱ��/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n��E�� | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n��E�� | 0.50 | 0.30 | 0.18 | �� | 0.15 |
| A�� | �¶ȣ�T1��T2 | |
| B�� | ƽ�ⳣ����K��T1����K��T2�� | |
| C�� | T2�¶���10min�ڣ�ƽ������Ϊv��E��=0.020mol•L-1•min-1 | |
| D�� | T1�¶��´ﵽƽ����ٳ���0.50mol E��1.0mol F���ﵽ��ƽ��ʱE��Ũ�Ȳ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
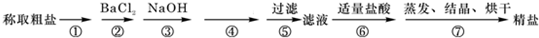
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
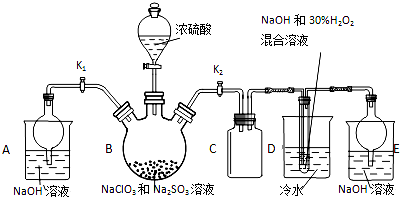 �������ƣ�NaClO2������ҪƯ����̽��С�鿪չ����ʵ�飬��ش�
�������ƣ�NaClO2������ҪƯ����̽��С�鿪չ����ʵ�飬��ش��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
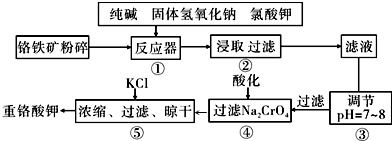
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ȫ�����飨C3F8����ȫ�����飨CF4����Ϊͬϵ�� | |
| B�� | ʯī�ܵ��磬����ʯī���ڵ���� | |
| C�� | �ڻ�ѧ��Ӧ�У�ԭ�ӵ��������Ŀ�����ֲ��� | |
| D�� | �ɱ���������ú�����������������仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
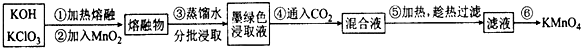
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Һ��Na+��Ŀ���� | |
| B�� | ��Һ���������ݳ� | |
| C�� | ���ʵ������������� | |
| D�� | ��Һ�������٣����ʵ������������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com