某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面并使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节酸式滴定管液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度完成以下填空:
(1)正确操作的顺序是(用序号字母填写)
BDCEAF
BDCEAF
.
(2)上述(B)操作的目的是
防止将标准液稀释
防止将标准液稀释
.
(3)上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,下同)
偏大
偏大
.
(4)实验中用左手控制
碱式滴定管橡皮管玻璃珠处
碱式滴定管橡皮管玻璃珠处
(填仪器及部位),眼睛注视
锥形瓶中溶液的颜色变化
锥形瓶中溶液的颜色变化
,直至滴定终点.判断到达终点的现象是
锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色
锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色
.
(5)若称取一定量的KOH固体(含少量K
2CO
3)配制标准溶液并用来滴定上述盐酸,则对测定结果的影响是
偏大
偏大
.
(6)滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是
偏大
偏大
.
(7)若用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是
DE
DE
.
A.锥形瓶中待测液在晃动时溅出了一些
B.滴定起始读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管.

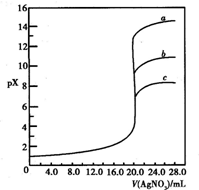 用0.1mol?L-1?AgNO3溶液分别滴定20.00mL含Cl-、Br-、I-浓度均为0.1mol?L-1的溶液,以滴入的AgNO3溶液的体积为横坐标,pX为纵坐标[pX=-lg c(X),X=Cl-、Br-、I-],可得如图所示的滴定曲线.已知25℃时,部分难溶盐的Ksp和颜色如表所示:
用0.1mol?L-1?AgNO3溶液分别滴定20.00mL含Cl-、Br-、I-浓度均为0.1mol?L-1的溶液,以滴入的AgNO3溶液的体积为横坐标,pX为纵坐标[pX=-lg c(X),X=Cl-、Br-、I-],可得如图所示的滴定曲线.已知25℃时,部分难溶盐的Ksp和颜色如表所示: