
| 20×10-3L×0.01mol/L-10×10-3L×0.01mol/L |
| (20+30)×10-3L |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、SO2具有漂白性,可用作熏蒸粉丝使其增白 | B、常温下,二氧化硅不与强酸反应,可用石英容器盛放氢氟酸 | C、铜的金属活泼性比铁弱,可在铁船闸上装若干铜块以减缓其腐蚀 | D、氧化铝熔点很高,可制造高温耐火材料,如制耐火管,坩埚等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大力发展电动车,减少燃油汽车的尾气排放量 | B、燃煤时加入适量石灰石,减少SO2排放 | C、多环芳烃是强致癌物,能吸附在PM 2.5的表面进入人体 | D、PM 2.5含有的铅、镉、铬、钒、砷等元素,它们属于第三周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、MgCl2 | B、NaCl | C、NaNO2 | D、NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
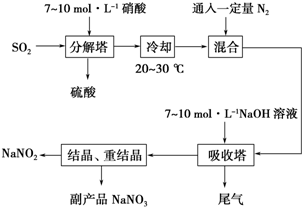
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子晶体中分子间作用力越大,分子越稳定 | B、原子晶体中共价键越强,则晶体的熔点越高 | C、冰融化时水分子中H-O键未发生断裂 | D、冰的密度比液态水的密度小与水分子间的氢键有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丙烯和乙烯、丁二烯互为同系物 | B、丙烯与环丙烷互为同分异构体 | C、丙烯的沸点大于乙烯 | D、理论上,等质量的聚丙烯和丙烯完全燃烧消耗的氧气相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、B40、C70都属于新型化合物 | B、C60和14C互称同位素 | C、B40、C60、C70、N60都属于烯烃 | D、B40、C60、C70、N60都只含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在钠、钾、铷,三种单质中,铷的熔点最高 | B、充电电池的化学反应原理是氧化还原反应,充电是使放电时的氧化还原反应逆向进行,燃料电池的能量利用率可达100% | C、化学键可以使离子相结合,也可以使原子相结合 | D、氟利昂-12(CF2Cl2)有两种同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com