

���� ��1��������˷�Ӧ���ʱ䣬�����Ȼ�ѧ����ʽ����д������д���Ȼ�ѧ����ʽ��
��2�����ݵ����������ķ�Ӧ֮�ȣ���֪YΪ���������ݻ�ѧ��Ӧ���ʼ��㹫ʽ������
��3���Ʊ�����ĵ�һ����Ӧ�ǰ��Ĵ���������һ��������ˮ�����ݻ��ϼ۷�����ԭ������ݵ����غ��������������
��� �⣺��1���÷�Ӧ���ʱ��H=E1-E2=134KJ/mol-368KJ/mol=-234KJ/mol���ʴ�Ϊ��NO2��g��+CO��g��=CO2��g��+NO��g����H=-234kJ•mol-1��
��2�����ݵ����������ķ�Ӧ֮�ȣ���֪YΪ������2min��N2�ķ�Ӧ���ʦԣ�N2��=$\frac{��c}{��t}$=$\frac{0.1mol}{0.5L��2min}$=0.1mol•L-1•min-1���ʴ�Ϊ��H2��0.1mol•L-1•min-1��
��3���Ʊ�����ĵ�һ����Ӧ�ǰ��Ĵ���������һ��������ˮ����4NH3+5O2$\frac{\underline{����}}{��}$4NO+6H2O�������еĵ�Ԫ�ػ��ϼ۽��ͣ���NO��NO2Ϊ��ԭ�������õ���NO��NO2���ʵ�����ͬ�������Ϊ1mol����Ԫ�صĵ�����Ϊ4������һ�μӷ�Ӧ��ͭ�����ʵ���Ϊ2mol��0.6mol Cu��������ȫ�ܽ������0.3mol��һ��������0.3mol������������õ���״�����������Ϊ22.4L/mol��0.6mol=13.44L���ʴ�Ϊ����4NH3+5O2$\frac{\underline{����}}{��}$4NO+6H2O����NO��NO2��13.44��
���� ���⿼���Ȼ�ѧ����ʽ����д�����ݷ�Ӧ����������������Ĵ�С�����Ӧ�ȣ��Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
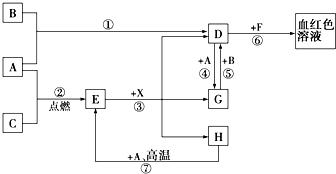 A��B��CΪ��ѧ�������ʣ�����һ��Ϊ������ͨ������£�AΪ���壬BΪҺ�壬CΪ���壮D��E��F��G��H��X��Ϊ���������X��һ������ǿ�ᡢEΪ��ɫ���壬H�ڳ�����ΪҺ�壮����֮���ת����ϵ��ͼ��ʾ������ijЩ��Ӧ�����Ͳ��ַ�Ӧ��������ȥ����
A��B��CΪ��ѧ�������ʣ�����һ��Ϊ������ͨ������£�AΪ���壬BΪҺ�壬CΪ���壮D��E��F��G��H��X��Ϊ���������X��һ������ǿ�ᡢEΪ��ɫ���壬H�ڳ�����ΪҺ�壮����֮���ת����ϵ��ͼ��ʾ������ijЩ��Ӧ�����Ͳ��ַ�Ӧ��������ȥ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| Fe2O3 | CO | Fe | CO2 | |
| ��/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| ��/mol | 1.0 | 2.0 | 1.0 | 1.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 2013��12��15��4ʱ���س���ϵ�л���ġ����úš�˳��ʻ��������棬ʵ�������Ǻ���ҫ����Ĵ��٣����������Ҫ����ȼ�ϣ�ͨ�����£�N2H4����ȼ�ϣ�N2O4������������ش��������⣺
2013��12��15��4ʱ���س���ϵ�л���ġ����úš�˳��ʻ��������棬ʵ�������Ǻ���ҫ����Ĵ��٣����������Ҫ����ȼ�ϣ�ͨ�����£�N2H4����ȼ�ϣ�N2O4������������ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��������Ҫ���Եز�����ʣ���������ơ�����þ����̬���ڣ�����������������Ҫ��Ӧ�ã�
��������Ҫ���Եز�����ʣ���������ơ�����þ����̬���ڣ�����������������Ҫ��Ӧ�ã��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��� �ܣ��٣��ڣ��� | B�� | �ܶ� �٣��ܣ��ۣ��� | ||
| C�� | ���� �ܣ��٣��ۣ��� | D�� | ��ԭ���� �ڣ��ܣ��ۣ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����Ȼ��Ϊԭ�Ϻϳɼ״������ķ�����ˮú����Ŀǰ���ڿ�����ֱ��������
����Ȼ��Ϊԭ�Ϻϳɼ״������ķ�����ˮú����Ŀǰ���ڿ�����ֱ���������鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com