
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
分析 (1)根据溶液中电荷守恒计算;
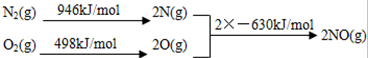
(2)根据能量变化图计算反应热,反应热=反应物的键能和-生成物的键能和,从而书写热化学方程式;
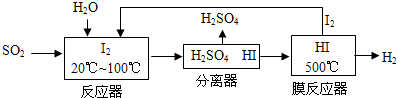
(3)①从流程图可知,在反应器中,I2氧化SO2,生成硫酸和HI;
②KOH溶液作为电解质溶液,负极为氢气失电子发生氧化反应的过程,据此书写;
(4)①太阳能是取之不尽用之不竭的能源;
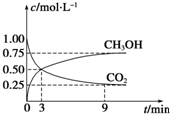
②v(H2)=3v(CO2)=$\frac{△c}{△t}$计算;
③可根据化学平衡状态的概念和化学平衡状态的特征“等”和“定”来分析解答;
④A、依据平衡常数随温度变化和平衡移动原理分析判断;
B、根据△G=△H-T△S<0自发,△G=△H-T△S>0非自发判断;
C、结合平衡三段式列式计算,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
D、此条件是催化剂活性最大,升温平衡逆向进行.
解答 解:(1)溶液中电荷守恒:C(K+)+C(NH4+)+c(Na+)+C(H+)=2C(SO42-)+C(NO3-)+C(Cl-)+c(OH-)和KW,得C(H+)=1×10-4mol•L-1,pH值为4,
故答案为:4;
(2)该反应中的反应热=反应物的键能和-生成物的键能和=(946+498)kJ/mol-2×630kJ/mol=+184kJ/mol,所以N2和O2反应生成NO的热化学反应方程式为N2(g)+O2(g)=2NO(g)△H=+184kJ•mol-1;
故答案为:N2(g)+O2(g)=2NO(g)△H=+184kJ•mol-1;
(3)①从流程图可知,在反应器中,I2氧化SO2,生成硫酸和HI,反应方程式为SO2+I2+2H2O=SO42-+2I-+4H+,故答案为:SO2+I2+2H2O=SO42-+2I-+4H+;
②KOH溶液作为电解质溶液,负极为氢气失电子发生氧化反应的过程,则方程式为:H2-2e-+2OH-=2H2O,故答案为:H2-2e-+2OH-=2H2O;
(4)①太阳光是取之不尽用之不竭的能源,故C最节能,故答案为:C;
②v(H2)=3v(CO2)=3$\frac{△c(C{O}_{2})}{△t}$=3×$\frac{(0.5-0.25)mol/L}{6min}$=0.125mol/(L•min),故答案为:0.125;
③A.反应中CO2与CH3OH的物质的量浓度之比为1:1,不能说明正逆反应速率相等,不能说明化学反应达到化学平衡,故A错误;
B.体积不变,质量不变,则混合气体的密度不随时间的变化而变化,不能利用密度判断平衡,故B错误;
C.单位时间内每消耗3mol H2,同时生成1mol H2O,体现正反应速率,无法确定正逆反应速率的关系,故C错误;
D.CO2的体积分数在混合气体中保持不变,化学反应达到化学平衡,故D正确;
故答案为:D;
④A、依据平衡常数随温度变化和平衡移动原理分析判断,随温度升高平衡常数减小,正反应为放热反应,故A正确;
B、由A得正反应为放热反应,△H<0,△S<0,根据△G=△H-T△S<0自发,△G=△H-T△S>0非自发,所以低温下能自发进行,高温下不能自发进行,故B错误;
C、结合平衡三段式列式计算,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,
CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L) 0.1 0.2 0
变化量(mol/L) 0.1×50% 0.1 0.05
平衡量(mol/L) 0.05 0.1 0.05
平衡常数K=$\frac{0.05}{0.05×0.{1}^{2}}$=100,故C正确;
D、升温平衡逆向进行,此条件是催化剂活性最大,不是原料气的转化率高,故D错误;
故答案为:AC.
点评 本题考查了电解质溶液中的电荷守恒、反应热=反应物的键能和-生成物的键能和、电化学、化学平衡状态的判断、化学平衡的影响因素等知识,题目难度不大.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:解答题

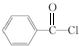 ,丁
,丁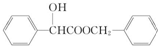 .
.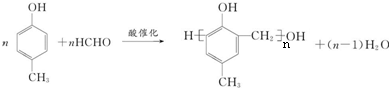 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H与D | B. | CH3CH2OH与CH3COOH | ||
| C. | CH≡CH与C6H6 | D. | CH3CH2CH2CH3与 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 装置 | 现象 | 结论及解释 |
 | ①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 | a.现象②说明褐色沉淀具有 还原性. b.试管B中产生白色沉淀的总反应的离子方程式为 NO2+SO2+Ba2++H2O=BaSO4↓+NO+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②④⑥ | C. | ②④ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
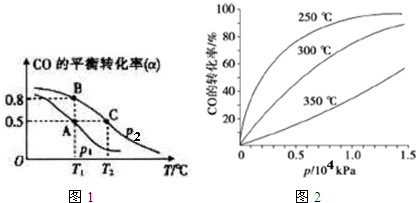
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
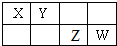 X、Y、Z、W是元素周期表中短周期元素,且原子序数依次递增,四种元素在元素周期表中的位置关系如图.四种元素的最高价含氧酸根离子一定能够水解的是( )
X、Y、Z、W是元素周期表中短周期元素,且原子序数依次递增,四种元素在元素周期表中的位置关系如图.四种元素的最高价含氧酸根离子一定能够水解的是( )| A. | X | B. | Y | C. | Z | D. | W |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 含有金属阳离子的晶体一定是离子晶体 | |
| B. | 化合物硫氰化铁和氢氧化二氨合银中都存在配位键 | |
| C. | KCl、HF、CH3CH2OH、SO2都易溶于水,且原因相同 | |
| D. | MgO的熔点比NaCl的高,主要是因为MgO的晶格能大于NaCl的晶格能. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6g金属铁于足量的盐酸反应,转移电子数为0.2NA | |
| B. | 标准状况下,以任意比混合的H2、CO2的混合气体22.4L,所含分子数为NA | |
| C. | 含NA个Na+的Na2O2溶于1L水中,溶质的物质的量浓度为1mol•L-1 | |
| D. | 20g重水(D2O)所含的电子数为10NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com