
| A. | (3a+0.5b)mol | B. | (3a+0.5b)mol | C. | (3a+0.5b+3p)mol | D. | (3a+0.5b-3p)mol |
分析 根据元素守恒,反应后混合气体的耗氧量即是amolC2H4和bmolH2的耗氧量,反应物为CO2和H2O,根据质量守恒可计算出最终消耗的氧气.
解答 解:反应前后C和H反应后元素的质量没有发生变化,则混合气体的耗氧量即是amolC2H4和bmolH2的耗氧量,
原混合物中含有C的物质的量为2amol,H的物质的量为4amol+2bmol,
根据反应物为CO2和H2O,1molC消耗1mol氧气,1molH消耗$\frac{1}{4}$mol氧气,
则消耗的氧气的物质的量为:2amol+$\frac{4}{4}$amol+$\frac{2}{4}$=(3a+0.5b)mol,
故选A.
点评 本题考查混合物的计算,为高频考点,侧重于学生的分析、计算能力的考查,题目难度不大,本题注意反应后混合气体的耗氧量即是amolC2H4和bmolH2的耗氧量,根据1molC消耗1mol氧气,1molH消耗$\frac{1}{4}$mol氧气计算.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
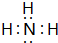 (或
(或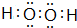
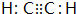 ).
).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
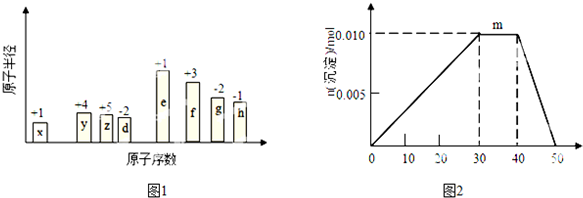
科目:高中化学 来源: 题型:解答题
| 元素 | 有关信息 |
| X | 最外层电子数是次外层的2倍 |
| Y | 元素主要化合价为-2价 |
| Z | 其单质及化合物的焰色为黄色 |
| M | 与X同主族,其单质为半导体材料 |
| N | 其单质在Y单质中燃烧,发出明亮的蓝紫色火焰 |
 ;
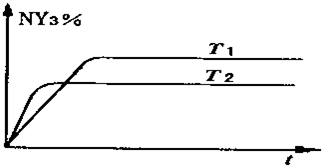
;
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
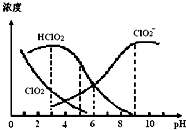
| A. | 使用该漂白剂的适宜pH约为5.0 | |
| B. | 该温度下NaClO2溶液中:c( Na+)>c(ClO2-)>c(OH-)>c(H+) | |
| C. | 该温度下HClO2的电离平衡常数的数值Ka≈1.0×10-6 | |
| D. | 不同pH的NaClO2溶液中存在下列关系:c( Na+)=c(ClO2-)+c(HClO2)+c(ClO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
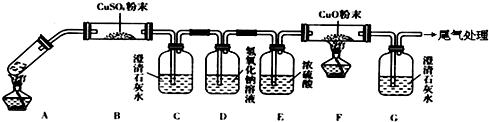
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②过程中都只发生了物理变化 | |
| B. | 石油主要是由各种烷烃、环烷烃、芳香烃组成的混合物 | |
| C. | 石油的分馏产品中不能得到汽油、柴油 | |
| D. | ③是加成反应,产物名称是1,2-溴乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 2OH-+H2↑+Cl2↑;.
2OH-+H2↑+Cl2↑;.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com