
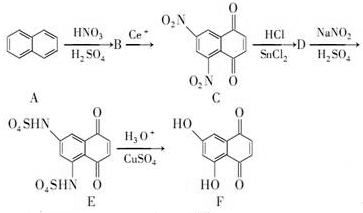
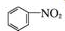 +SnCl2$\stackrel{HCl}{→}$
+SnCl2$\stackrel{HCl}{→}$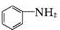 +SnCl4
+SnCl4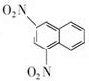 .
. 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 20倍 | B. | 100倍 | C. | 200倍 | D. | 500倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某研究性学习小组设计了一组实验验证元素周期律.
某研究性学习小组设计了一组实验验证元素周期律.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
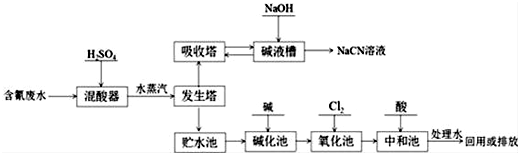
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E都是周期表中前四周期原子序数依次增大的元素.其中A、B、C是同一周期的非金属元素.D与C可以形成两种常见的离子晶体,D的阳离子与C的阴离子具有相同的电子层结构.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物M,且两种配体的物质的量之比为2:1,三个氯离子位于外界.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是周期表中前四周期原子序数依次增大的元素.其中A、B、C是同一周期的非金属元素.D与C可以形成两种常见的离子晶体,D的阳离子与C的阴离子具有相同的电子层结构.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物M,且两种配体的物质的量之比为2:1,三个氯离子位于外界.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+2c(H2S) | |
| B. | 常温下,0.1 mol•L-1HA溶液与0.1 mol•L-1 NaOH溶液正好完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) | |
| C. | 常温下,向0.1 mol•L-1CH3COOH 溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中的$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$值增大到原来的10倍 | |
| D. | 常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol•L-1:c(Na+)=c(CH3COOH)>c(CH3COO-)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2的摩尔质量是60 | |
| B. | 1mol SiO2中含有1mol O2 | |
| C. | 1.5mol SiO2中含有1.806×1024个氧原子 | |
| D. | 1mol SiO2的质量是60g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAl(SO4)2溶液中滴加Ba(OH)2直至SO42-沉淀完全:2Al3++6OH-+3SO42-+3Ba2+=2Al(OH)3↓+3BaSO4↓ | |
| B. | NH4HS溶液与少量的NaOH溶液反应:NH4++OH-=NH3•H2O | |
| C. | 稀H2SO4和Na2S2O3溶液共热:S2O32-+2H+$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+S↓+H2O | |
| D. | 过量Cl2通入Fel2溶液中:3Cl2+2I-+4Fe2+=4Cl-+I2+4Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | a | b | c |
| 合金质量(g) | 0.51 | 0.765 | 0.918 |
| 气体体积(mL) | 560 | 672 | 672 |
 (3)向c组试验后的容器中加入78mL 1.0mol/L的氢氧化钠溶液,可恰好使剩余合金中的铝完全溶解.
(3)向c组试验后的容器中加入78mL 1.0mol/L的氢氧化钠溶液,可恰好使剩余合金中的铝完全溶解.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com