
| A. | 用四氯化碳萃取碘水,下层溶液呈紫色 | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 往氯化铁溶液中加入氢氧化钠溶液可制得氢氧化铁胶体 | |
| D. | 某溶液滴加紫色石蕊试剂呈红色,该溶液一定含有某种酸 |
分析 A.四氯化碳的密度比水的密度大,分层,且碘易溶于四氯化碳;
B.白色沉淀可能为AgCl;
C.氯化铁溶液中加入氢氧化钠溶液,发生复分解反应生成沉淀;
D.滴加紫色石蕊试剂呈红色,溶液显酸性.
解答 解:A.四氯化碳的密度比水的密度大,分层,且碘易溶于四氯化碳,则四氯化碳萃取碘水,下层溶液呈紫色,故A正确;
B.白色沉淀可能为AgCl,则原溶液中可能含银离子或硫酸根离子,但二者不能同时存在,故B错误;
C.氯化铁溶液中加入氢氧化钠溶液,发生复分解反应生成沉淀,不能制备胶体,故C错误;
D.滴加紫色石蕊试剂呈红色,溶液显酸性,为酸或强酸的酸式盐、水解显酸性的盐等,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯、离子检验、胶体制备、水解与电离等为解答该题的关键,侧重分析与实验能力的考查,注意实验的评价性分析,选项D为易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | S→SO3 | B. | Fe→FeCl2 | C. | SiO2→H2SiO3 | D. | Al2O3→Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 选用100mL容量瓶,并用蒸馏水洗净后烘干 | |
| B. | 称取5.9g NaCl固体倒入容量瓶中溶解 | |
| C. | 定容时俯视刻度会导致浓度偏高 | |
| D. | 摇匀、静置后发现凹液面低于刻度线1~2mm,用胶体滴管加水至与刻度线相平即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
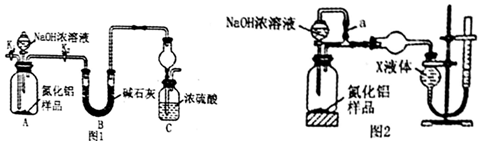
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②④⑥ | B. | 只有③④⑥ | C. | 只有①③⑤ | D. | 只有①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 →
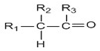
→
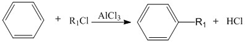
 +R1Cl$\stackrel{AlCl_{3}}{→}$
+R1Cl$\stackrel{AlCl_{3}}{→}$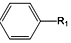 +HCl
+HCl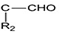 +H2O(R1、R2、R3代表烃基或氢原子)回答下列问题:
+H2O(R1、R2、R3代表烃基或氢原子)回答下列问题: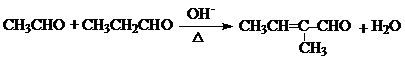 .
.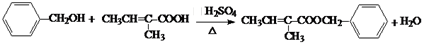 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C 的生成速率与 C 的分解速率相等 | |
| B. | 单位时间内消耗 amolA,同时生成 3amolC | |
| C. | 容器内压强不再变化 | |
| D. | 混合气体的物质的量不再变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com