
【题目】海洋中无机氮的循环过程可用如图表示。下列说法正确的是(已知:反应④的离子方程式为4NH4+ + 5O2![]() 2NO2- + 6H+ + N2O + 5H2O)
2NO2- + 6H+ + N2O + 5H2O)

A. ①②均属于固氮反应
B. 海洋中的反硝化作用一定需要氧气参加
C. 反应④中每生成1 mol H2O转移2 mol e-
D. 向海洋排放含NO3-的废水可能影响海洋中氮的循环
【答案】D
【解析】
A.氮的固定是将空气中游离态的氮转化为含氮化合物的过程,所以只有②属于固氮反应,故A错误;
B.反硝化作用是指将硝酸盐转变成氮气的过程。硝化作用是指氨在微生物作用下氧化为硝酸的过程。硝化细菌将氨氧化为硝酸的过程,反硝化作用:反硝化细菌在缺氧条件下,还原硝酸盐,释放出分子态氮或一氧化二氮的过程,不一定有氧参加,故B错误;
C.反应④的离子方程式为4NH4++5O2=2NO2-+6H++N2O+5H2O,氧元素的化合价由0价降低为-2价,该过程中共转移2×10=20个电子,所以每生成1molH2O转移4mole-,故C错误;
D.转化关系图中硝酸根离子增多,反硝化作用增强,向海洋排放含的废水会影响海洋中的含量,影响海洋中N元素循环,故D正确。
故D正确。


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】细胞中常见的化学元素有20多种,其中有些含量较多,称为大量元素;有些含量很少,称为微量元素。下列各组元素中,全是微量元素的是
A.Fe、Mn、B、Mo、SB.C、H、O、Ca、Mg
C.P、N、K、Ca、MgD.Mo、Zn、Cu、B、Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有室温下四种溶液,有关叙述不正确的是
编号 | ① | ② | ③ | ④ |
pH | 10 | 10 | 4 | 4 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
A. 相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④
B. 分别加水稀释10倍,四种溶液的pH:①>②>④>③
C. ①、④两溶液等体积混合,所得溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D. VaL④溶液与VbL②溶液混合(近似认为混合溶液体积=Va+Vb),若混合后溶液pH=5,则Va︰Vb=9︰11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
A. 向0.10mol·L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-)
B. 向0.10mol·L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-)
C. 0.10mol·L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
D. 0.10mol·L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示:
化学式 | CH3COOH | H2CO3 | HClO | |
电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
回答下列问题:
(1)物质的量浓度均为0.1mol·L-1的四种溶液:
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由小到大排列的顺序是________(用字母编号填写)。
(2)常温下,0.1mol·L-1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是___(填字母)。
A.c(H+)
B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH-)
D.c(OH-)/c(H+)
E.c(H+)·c(CH3COO-)/c(CH3COOH)
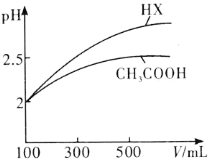
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
(4)标准状况下,将1.12L CO2通入100mL 1mol·L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:
①c(OH-)=2c(H2CO3)+________;
②c(H+)+c(Na+)=________。
(5)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=________mol·L-1(填精确值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)可作净水剂,也可用于制造高铁电池。高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时正极反应式为________。用该电池电解100mL 1mol·L-1的AgNO3溶液,当电路中通过0.01mol电子时,被电解溶液的pH为________(溶液体积变化忽略不计)。
3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时正极反应式为________。用该电池电解100mL 1mol·L-1的AgNO3溶液,当电路中通过0.01mol电子时,被电解溶液的pH为________(溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)![]() C8H8(g)+H2(g) ΔH=+125kJ·mol-1。某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
C8H8(g)+H2(g) ΔH=+125kJ·mol-1。某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(1)当反应进行到20min时,该段时间内H2的平均反应速率是________。
(2)该温度下,该反应的化学平衡常数是________(保留两位有效数字)。
(3)若保持其他条件不变,用0.40mol H2(g)和0.40mol C8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨作电极电解下列溶液①稀H2SO4 ②K2SO4溶液 ③CuCl2溶液 ④CuSO4溶液 ⑤KOH溶液
(1)阴极、阳极都有气体产生,且体积比(相同条件下)为2∶1的是(填序号)__________,其阳极的电极反应式都是_________________________________________________,
阴极的电极反应式都是_________________________________________________,
总反应的化学方程式都是_________________________________________________。
(2)阴极、阳极都有气体产生,其中溶液酸性增强的是____________________。 (填序号)。
(3)一个电极析出金属,另一个电极逸出刺激性气味气体的是_______(填序号),
其阳极的电极反应式是___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧在烟气脱硝中的反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,下列选项中有关图象对应的分析正确的是( )
N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,下列选项中有关图象对应的分析正确的是( )
A | B | C | D |
|
|
|
|
平衡后升温,NO2含量降低 | 0~2 s内,v(O3)=0.2 mol·L-1·s-1 | v正:b点>a点 b点:v逆>v正 | 恒温,t1时再充入O3 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com