
【题目】下列离子方程式书写不正确的是
A. 向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2===I2+2H2O
B. 碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH-===BaCO3↓+H2O
C. 向Al2(SO4)3溶液中加入过量的氨水:Al3++4NH3·H2O===AlO2-+4NH4++2H2O
D. 用铁棒作阴极,碳棒作阳极电解饱和氯化钠溶液:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】298K时,在20.00 mL 0.1 mol·L-1 C6H5COOH(苯甲酸)溶液中滴加0.1 mol·L-1 NaOH溶液,溶液中离子浓度与pH关系如图所示。下列说法正确的是
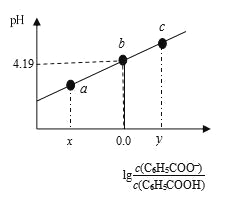
A. a点:溶液中c(Na+)>c(C6H5COO-)>c(H+)>c(OH-)
B. b点:对应的NaOH溶液体积为10 mL
C. 对b点溶液加热(不考虑挥发),实现曲线由b点向c点的变化
D. 298K时,C6H5COOH的电离常数为1×10-4.19
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列试剂的保存方法正确的是( )
A.浓硝酸保存在无色玻璃瓶中B.少量的白磷保存在冷水中
C.浓硫酸用橡胶塞细口瓶密闭保存D.烧碱溶液保存在玻璃塞试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见( )
A.NH4HCO3和盐酸的反应是放热反应
B.该反应中,热能转化为产物内部的能量
C.反应物的总能量高于生成物的总能量
D.反应的热化学方程式为:NH4HCO3+HCl=NH4Cl+CO2↑+H2O ΔH=+Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】秦皮是一种常用的中药,具有抗炎镇痛、抗肿瘤等作用。“秦皮素”是其含有的一种有效成分,结构简式如下图所示,有关其性质叙述不正确的是
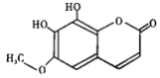
A. 1mol 该化合物最多能与3 mol NaOH 反应 B. 该有机物分子式为C10H8O5
C. 该有机物能发生加成、氧化、取代等反应 D. 分子中有四种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:

已知:
①2KOH + Cl2 = KCl + KClO + H2O(条件:温度较低)
②6KOH + 3Cl2 = 5KCl + KClO3 + 3H2O(条件:温度较高)
③2Fe(NO3)3 + 3KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
(1)该生产工艺应在______________(填“温度较高”或“温度较低”)情况下进行,从绿色化学的角度考虑通入氯气速率应________(填“较快”或“较慢”);
(2)写出工业上制取Cl2的化学方程式_____________________________________;
(3)K2 FeO4可作为新型多功能水处理剂的原因是______________________;
(4)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度为____________(保留整数);
(5)在“反应液I”中加KOH固体的目的是__________:
A.与“反应液I”中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3转化为 KClO
(6)从“反应液II”中分离出K2FeO4后,会有副产品_____________(写化学式)。
(7)该工艺每得到1.98 kg K2FeO4,理论上消耗Cl2的物质的量为___________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关 HCl 和 HBr 的叙述错误的是( )
A.键能:HCl>HBrB.热稳定性:HBr>HCl
C.沸点:HBr>HClD.共用电子对偏移程度:HCl>HBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是( )


A. ①是其他条件一定时,反应速率随温度变化的图像,正反应ΔH<0
B. ②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图像
C. ③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线
D. ④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究硫酸亚铁的分解产物,进行了如下图装置所示的实验,打开K1和K2,缓缓通入N2,一段时间后加热,实验后反应管中残留固体为红色粉末,BaCl2溶液中有白色沉淀产生,品红溶液中红色褪去,检查氢氧化钠溶液出口处无氧气产生。下列说法错误的是

A. 氢氧化钠溶液的作用是吸收多余的SO2气体
B. 反应管内产生的红色粉末可能是Fe2O3
C. BaCl2溶液的目的是检验SO3的存在,此处用Ba(NO3)2溶液也可以检验SO3
D. 反应管内得到的氧化产物和还原产物物质的量之比为1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com