
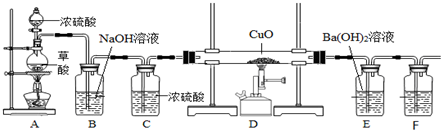
分析 探究高温下用CO还原CuO的固体产物的成分:先制备纯净的一氧化碳,依据装置图可知,装置A加热分解生成一氧化碳、二氧化碳和水蒸气,通过装置B吸收二氧化碳,通过装置C吸收水蒸气,得到纯净的一氧化碳气体,通过装置D进行CO能还原CuO,通过装置E用氢氧化钡溶液,验证生成的二氧化碳,通过装置F,F装置中的PdCl2溶液可以吸收多余的CO,反应后溶液变黑(Pd).
(1)该实验有气体参与,为保证实验的顺利完成,需检验装置的气密性;
(2)实验开始时,先往A装置的圆底烧瓶中加入一定量的浓硫酸,再点燃酒精灯,先制取一氧化碳,根据F装置中的PdCl2溶液可以吸收多余的CO,反应后溶液变黑(Pd)判断一氧化碳是否已经生成;
(3)通过装置D进行CO能还原CuO,通过装置E用氢氧化钡溶液,验证生成的二氧化碳,需通过装置B吸收二氧化碳,防止干扰后面生成的二氧化碳的验证;
(4)CO还原CuO的固体产物的成分可能为Cu2O或Cu,或两者的混合物,分析判断;
(5)F装置中的PdCl2溶液可以吸收多余的CO,反应后溶液变黑(Pd),根据氧化还原反应原理,化合价升高的为碳由+2价变为+4价;
(6)①甲同学取少量称量后的固体放入200mL 3.0mol•L-1的氨水中,充分混合一段时间后,测得溶液的pH没有改变,说明未发生Cu2O+4NH3•H2O=2[Cu (NH3)2]++3H2O+2OH-该反应,说明无Cu2O,根据氧、铜质量守恒计算该反应中CuO的转化率;
②装置中残留二氧化碳,计算出CuO的转化率偏小.
解答 解:探究高温下用CO还原CuO的固体产物的成分:先制备纯净的一氧化碳,依据装置图可知,装置A加热分解生成一氧化碳、二氧化碳和水蒸气,通过装置B吸收二氧化碳,通过装置C吸收水蒸气,得到纯净的一氧化碳气体,通过装置D进行CO能还原CuO,通过装置E用氢氧化钡溶液,验证生成的二氧化碳,通过装置F,F装置中的PdCl2溶液可以吸收多余的CO,反应后溶液变黑(Pd).
(1)探究高温下用CO还原CuO的固体产物的成分,需制备一氧化碳,需进行一氧化碳与氧化铜反应,为保证实验的顺利完成,所以需检查装置气密性,
故答案为:检查装置气密性;
(2)实验中需排尽装置中的氧气,所以先制取一氧化碳,实验开始时,先往A装置的圆底烧瓶中加入一定量的浓硫酸,再点燃酒精灯,先制取一氧化碳,根据F装置中的PdCl2溶液可以吸收多余的CO,反应后溶液变黑(Pd)判断一氧化碳是否已经生成,所以F装置中开始出现黑色固体,一氧化碳已经充满装置,再点燃D处的酒精喷灯,
故答案为:F装置中开始出现黑色固体;
(3)装置D进行CO能还原CuO,气体产物为二氧化碳,需通过装置E氢氧化钡溶液,二氧化碳和氢氧化钡反应生成白色的碳酸钡沉淀,验证生成的二氧化碳,装置A加热分解H2C2O4 $→_{△}^{浓硫酸}$ CO↑+CO2↑+H2O,为防止制取一氧化碳中的二氧化碳干扰后续实验,需用装置B除去反应产生的CO2气体,防止干扰后面的测定,
故答案为:除去反应产生的CO2气体,防止干扰后面的测定;
(4)一氧化碳和氧化铜反应,主要生成铜和二氧化碳,假设1:还原产物为Cu2O; 假设2:还原产物为Cu,假设3:还原产物为两者的混合物,即Cu和Cu2O的混合物,
故答案为:Cu;Cu和Cu2O的混合物;
(5)F装置中的PdCl2溶液可以吸收多余的CO,反应后溶液变黑(Pd),根据氧化还原反应原理,化合价升高的为碳由+2价变为+4价的二氧化碳,所以反应为:PdCl2+CO+H2O=Pd+CO2+2HCl,
故答案为:PdCl2+CO+H2O=Pd+CO2+2HCl;
(6)①甲同学取少量称量后的固体放入200mL 3.0mol•L-1的氨水中,充分混合一段时间后,测得溶液的pH没有改变,说明未发生Cu2O+4NH3•H2O=2[Cu (NH3)2]++3H2O+2OH-该反应,说明无Cu2O,假设2、假设3不成立,甲同学通过信息推测固体的成分为Cu,反应前测CuO固体样品的质量为12.0g,待D装置中固体冷却后,称得固体的质量为10.4g,减少的质量为12g-10.4g=1.6g,为氧元素的质量,n(O)=$\frac{1.6g}{16g/mol}$=0.1mol,则分解的n(CuO)=0.1mol,该反应中CuO的转化率是$\frac{0.1mol×80g/mol}{12g}$×100%≈66.7%,
故答案为:Cu;66.7%;
②部分生成的CO2气体残留在装置D,错误计算为残留的固体质量,导致计算出的还原出的氧元素质量偏小,即计算出CuO的转化率比甲同学计算结果偏小,
故答案为:部分生成的CO2气体残留在装置D,导致结果偏小.
点评 本题考查了实验验证生成物成分、实验探究物质组成的分析判断,主要是产物的检验,物质性质的理解应用,培养了分析综合应用能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
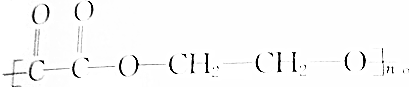 ,1mol该物质与足量NaOH溶液反应,消耗NaOH的物质的量为( )
,1mol该物质与足量NaOH溶液反应,消耗NaOH的物质的量为( )| A. | 2mol | B. | 4mol | C. | 2nmol | D. | 4nmol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 早在1 000多年前,我国就已采用加热胆矾(CuSO4•5H2O)或绿矾(FeSO4•7H2O) 的方法制硫酸,尽管硫酸的生产工艺几经改进,此方法仍然是工业生产硫酸的主要方法 | |
| B. | 氢能是未来能源结构中最具发展潜力的清洁能源之一.目前已有专家研究出用淀粉或纤维素与水在酶作用下转变为二氧化碳和氢气的方法制氢气.从整个循环来看,利用该方法得到的氢能来源于太阳能 | |
| C. | 在现代化学工业中催化剂的应用十分普遍,对于给定条件下反应物之间能够同时发生多个反应时,理想催化剂还可以大幅度提高目标产物在最终产物中的比率 | |
| D. | 有机反应中的加聚反应符合绿色化学的原则 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 目的 | 古代文献 | 说明 | |
| A | 使用 | “…凡研消(KNO3)不以铁碾入石臼,相激火生,祸不可测”-《天工开物》 | KNO3能自燃 |
| B | 性质 | “(火药)乃焰消(KNO3)、硫磺、山木炭所合,以为烽燧餇诸药者”-《本草纲目》 | 利用KNO3的氧化性 |
| C | 鉴别 | 区分硝石(KNO3)和朴消(Na2SO4):“以火烧之,紫青烟起,乃真硝石也”-《本草经集注》 | 利用焰色反应 |
| D | 提纯 | “…(KNO3)所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”-《开宝本草》 | 溶解、蒸发、结晶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;分子N中含有2个手性碳原子.
;分子N中含有2个手性碳原子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 火箭用偏二甲肼(C2H8N2)作燃料,N2O4作还原剂,反应产生巨大能量 | |
| B. | 铝制品由于表面有致密的氧化膜,可以稳定存在于空气中 | |
| C. | 硫是一种生命元素,自然界中的石膏矿、硫铁矿、赤铁矿等都是含“硫”为主的矿石 | |
| D. | 高纯度的SiO2对光有很好的折射和全反射作用,可以制成光电池将光能直接转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层电子构型为ns2(n≠1),次外层电子数为8 | |
| B. | 外围电子构型为3d104s2 | |
| C. | 外围电子排布式为ns2np4 | |
| D. | 外围电子排布式为(n-1)d5ns2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
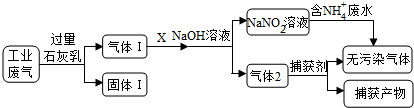
| A. | 固体Ⅰ中主要含有Ca(OH)2、CaCO3、CaSO3 | |
| B. | X可以是空气,且需过量 | |
| C. | 捕获剂所捕获的气体主要是CO | |
| D. | 处理含NH4+废水时,发生反应的离子方程式为:NH4++NO2-=N2↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com