
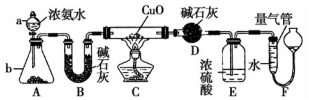
 某课外活动小组欲利用CuO与NH4反应,研究NH3的某种性质并测定其组成,设计了如图实验装置(夹持装置未画出)进行实验.请回答下列问题:
某课外活动小组欲利用CuO与NH4反应,研究NH3的某种性质并测定其组成,设计了如图实验装置(夹持装置未画出)进行实验.请回答下列问题:分析 浓氨水在氧化钙或氢氧化钠、碱石灰等作用下可放出大量的氨气,B中碱石灰用于干燥氨气,加热条件下,氨气与CuO发生氧化还原反应生成氮气和铜,D中碱石灰用于吸收氨气,E用于吸收氨气,F用于测量生成氮气的体积,测量气体体积时量气管液面应相等,以排除压强的影响,以此解答该题.
解答 解:(1)装置中仪器a为分液漏斗,故答案为:分液漏斗;
(2)利用装置A,可制取的无色气体;
a.制备氯气Cl2需要加热,且氯气为黄绿色气体,故a错误;
b.可以制备O2,利用固体过氧化钠和水的反应,故b正确;
c.可以制备CO2 气体,利用稀盐酸滴入大理石上反应生成,故c正确;
d.NO2是红棕色气体,故d错误;
故答案为:bc;
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,说明氨气和氧化铜反应生成铜和氮气与水,氨气被氧化铜氧化表现还原性,结合原子守恒配平写出的化学方程式为:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+3H2O+N2 ,故答案为:还原;3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+3H2O+N2 ;
(4)依据流程分析,浓硫酸是吸收过量的氨气,阻止F中水蒸气进入D影响实验效果,故答案为:吸收未反应的氨气,阻止F中水蒸气进入D;
(5)若测得干燥管D增重mg为水物质的量=$\frac{mg}{18g/mol}$,装置F测得气体的体积为nL(已折算成标准状况)为N2,物质的量=$\frac{nL}{22.4L/mol}$,依据元素守恒得到氮原子和氢原子物质的量之比=($\frac{nL}{22.4L/mol}$×2):($\frac{mg}{18g/mol}$×2)=,则氨分子中氮、氢的原子个数比为$\frac{9n}{11.2m}$,故答案为:$\frac{9n}{11.2m}$.
点评 本题考查较为综合,为高频考点,题目涉及氨气的实验室制备,性质验证和反应现象分析判断判断,装置流程分析,量气装置的使用方法,题目难度中等.试题有利于培养学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 称取3.55g硫酸钠,加入250mL水 | |
| B. | 称取2.84g硫酸钠,加水配成250mL溶液 | |
| C. | 称取6.44g硫酸钠晶体(Na2SO4•10H2O)配成250mL溶液 | |
| D. | 称取8.05g硫酸钠晶体(Na2SO4•10H2O)配成250mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol NH4+ 所含质子数为10NA | |
| B. | 10克氖气所含原子数约为6.02×1023 | |
| C. | 常温常压下,22.4 L SO2所含的分子数为NA | |
| D. | 常温常压下,32 g O2和O3的混合气体所含原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 点燃爆竹后,硫燃烧生成SO3 | |
| B. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| C. | 服用阿司匹林出现水杨酸反应时,用NaHCO3溶液解毒 | |
| D. | 高铁车厢大部分材料采用铝合金,因为铝合金强度大、质量轻、抗腐蚀能力强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5L 2mol/LBaCl2溶液中,钡离子和氯离子总数约为3NA | |
| B. | 从1L 1mol/L的NaCl溶液中取出10mL,其浓度仍为1mol/L | |
| C. | 配置0.5L 10mol/L的盐酸,需要标准状况下的氯化氢气体112L | |
| D. | 10mL质量分数为98%的硫酸,用水稀释至100mL,硫酸的质量分数为9.8% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com