
【题目】下列依据热化学方程式得出的结论正确的是
2C(s) +O2(g) =2CO (g) △H2则△H1<△H2
A.已知2SO2(g)+O2![]() 2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量
2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量
B.已知C(石墨,s)==C(金刚石,s)△H>0,则金刚石比石墨稳定
C.已知H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ/mol,则任何酸碱中和反应的热效应均为57.3 kJ
D.已知2C(s) +2O2(g) =2 CO2(g)△H1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】除去空气中的二氧化硫和氨氧化物气体对环境保护有重要意义。
(1)二氧化硫易溶于水,溶于水后所得溶液中H2SO3、HSO3-和SO32- 占三种粒子总数的比例随pH的变化如下图所示。由图可知H2SO3 的电离平衡常数Ka1=____________。

(2)利用尿素[CO(NH2)2]水解的溶液可以吸收含SO2 的空气。已知尿素水解放热,常温下水解反应较慢,水解的反应方程式如下:CO(NH2)2+H2O=H2NCOONH4(氨基甲酸铵)。
①氨基甲酸铵会与空气中的SO2 和O2 反应生成(NH4)2SO4,该反应的化学方程式为__________。
②一定条件下,用尿素溶液吸收含SO2 的空气,测得SO2 的吸收率随溶液的温度变化如图甲所示。温度高于60 ℃时,SO2 的吸收率逐渐升高的原因是_____________。
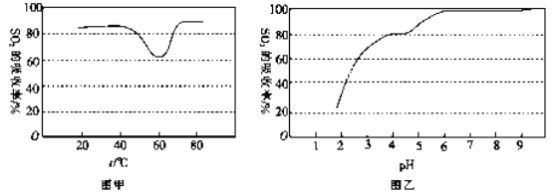
③尿素溶液吸收SO2 的吸收率随溶液的pH变化如图乙所示。尿素溶液吸收含SO2的空气后溶液的pH会降低,为提高SO2 的吸收率和充分回收产物,最好向溶液中加入_____(填溶液的名称)并控制pH 为_______。
(3)一种电化学脱硝法的原理如图所示。
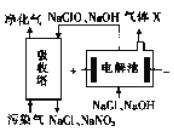
①电解池阴极所发生的电极反应为_____________。
②相同条件下通入的污染气和生成的X 的体积比为40 :3,污染气中NO 和NO2 占总体积的10%,若NaClO完全反应,污染气中NO和NO2 被完全吸收且其余气体不参与反应,则NO和NO2 的体积比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,向1.0L恒容密闭容器中充入1.0mol SO3气体,发生反应:2SO3(g)![]() 2SO2(g)+O2(g) △H=+196 kJ/mol,一段时间后达到平衡,测得此过程中从外界共吸收了19.6kJ的热量。当温度不变时,改变某一条件时,下列结论正确的是
2SO2(g)+O2(g) △H=+196 kJ/mol,一段时间后达到平衡,测得此过程中从外界共吸收了19.6kJ的热量。当温度不变时,改变某一条件时,下列结论正确的是
条件改变 | 结论 | |
A | 平衡后的容器中充入1.0molHe | 平衡逆向移动,化学平衡常数减小 |
B | 起始时向容器中充入1.0molSO2 和0.50molO2 | 达到平衡时共放出78.4kJ的热量 |
C | 起始时向容器中充入2.0 molSO3、0.50 molSO2和0.25 mol O2 | 反应达到平衡前v(正)>v(逆) |
D | 起始向容器中充入2.5 molSO2 和1.25molO2 | 达到平衡时,SO2的转化率为80.0% |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
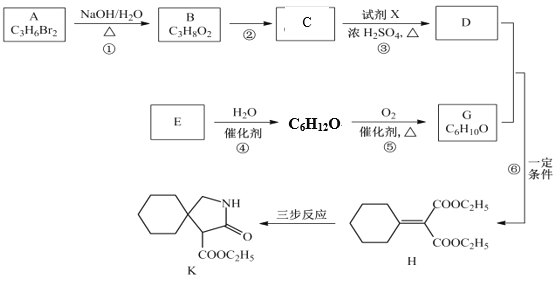
【题目】有机物K是某药物的前体,合成路线如图所示:
已知:R-CN ![]()
![]() ;
;
![]()
![]() +
+![]()
(1)B的结构简式是_____________。
(2)反应③的化学方程式是__________________。
(3)E属于烃,其分子式是_________________。
(4)H中含氧官能团的名称是_________________。
(5)写出满足下列条件的 K的一种同分异构体的结构简式:________________________
①遇氯化铁溶液显紫色; ②不含醚键; ③核磁共振氢谱显示峰面积之比为2:12:2:2:1
(6)H经三步反应合成K,写出J→K的化学方程式_____________________________。
![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示的是钢铁在海水中的锈蚀过程,以下有关说法正确的是( )
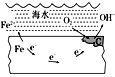
A. 该金属腐蚀过程为析氢腐蚀B. 正极为C,发生的反应为氧化反应
C. 该金属腐蚀过程是吸氧腐蚀D. 负极的反应式为O2+2H2O+4e-===4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有大量Na+、C1-及少量Ca2+、Mg2+、SO42-,用电渗析法对该海水样品进行淡化处理,如右图所示。下列说法正确的是

A. b膜是阳离子交换膜
B. A极室产生气泡并伴有少量沉淀生成
C. 淡化工作完成后A、B、C三室中pH大小为pHA<pHB<pHC
D. B极室产生的气体可使湿润的KI淀粉试纸变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知几种化学键的键能和热化学方程式如下:
化学键 | H—N | N—N | Cl—Cl | N | H—Cl |
键能/(kJ·mol-1) | 391 | 193 | 243 | 946 | 432 |
N2H4(g)+2Cl2(g)=N2(g)+4HCl(g) ΔH,下列推断正确的是( )
A.H(g)+Cl(g)=HCl(g) ΔH=+432kJ·mol-1
B.断裂1molCl—Cl键吸收能量比断裂1molN![]() N键多703kJ
N键多703kJ
C.上述反应中,ΔH=-431kJ·mol-1
D.上述反应中,断裂极性键和非极性键,只形成极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究NaClO溶液的性质,设计了下列实验,并记录实验现象。
实验装置 | 实验序号 | 滴管试剂 | 试管试剂 | 实验现象 |
| ① | 0.2 mol/L NaClO溶液 | 饱和Ag2SO4溶液 | 产生白色沉淀 |
② | CH3COOH溶液 | 光照管壁有无色气泡 | ||
③ | 0.2mol/LFeSO4酸性溶液和KSCN溶液 | 溶液变红 | ||
④ | 0.2mol/L的AlCl3溶液 | 产生白色沉淀 |
则以下判断不正确的是
A. 实验①:发生的反应为Ag++ClO-+H2O=AgCl↓+2OH- B. 实验②:无色气体为O2
C. 实验③:还原性强弱顺序Fe2+>Cl- D. 实验④:ClO-与Al3+的水解相互促进
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
黄铜矿是主要的炼铜原料,CuFeS2是其中铜的主要存在形式。回答下列问题:
(1)CuFeS2中存在的化学键类型是_______。其组成的三种元素中电负性较强的是 _______。
(2)下列基态原子或离子的价层电子排布图正确的______。
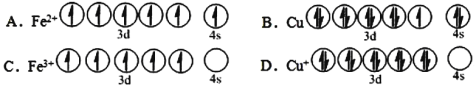
(3)在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
①X分子的立体构型是____,中心原子杂化类型为____,属于_______(填“极性”或“非极性”)分子。
②X的沸点比水低的主要原因是___________。
(4)CuFeS2与氧气反应生成SO2,其结构式为![]() ,则SO2中共价键类型有_________。
,则SO2中共价键类型有_________。
(5)四方晶系CuFeS2晶胞结构如图所示。
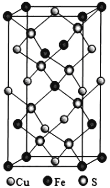
①Cu+的配位数为__________,
②已知:a=b=0.524 nm,c=1.032 nm,NA为阿伏加德罗常数的值,CuFeS2晶体的密度是________gcm3(列出计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com