
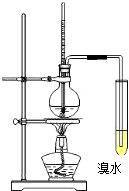
 ʵ������Ũ����;ƾ�Ϊԭ����ȡ��ϩ��������ϩ����ʵ���װ����ͼ��ʾ��
ʵ������Ũ����;ƾ�Ϊԭ����ȡ��ϩ��������ϩ����ʵ���װ����ͼ��ʾ��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��һ���¶��£�ѹ�����������������Ӧ���ʼӿ죬�淴Ӧ���ʼ��� | ||
| B�����״����������ʵ���һ����̼���������ʣ���÷�Ӧ�ﵽƽ��״̬ | ||
C�������¶ȣ����´ﵽƽ��ʱ��
| ||
| D��ʹ�ô�������Ӧ��ƽ�ⳣ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
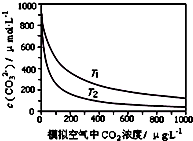 ������CO2������������˵��µ�������¶������⣬����Ӱ�캣����̬������ij�о�С����ʵ���Ҳ�ò�ͬ�¶��£�T1��T2����ˮ��CO32-Ũ����ģ�������CO2Ũ�ȵĹ�ϵ���ߣ�����˵������ȷ���ǣ�������
������CO2������������˵��µ�������¶������⣬����Ӱ�캣����̬������ij�о�С����ʵ���Ҳ�ò�ͬ�¶��£�T1��T2����ˮ��CO32-Ũ����ģ�������CO2Ũ�ȵĹ�ϵ���ߣ�����˵������ȷ���ǣ�������| A��T1��T2 |
| B����ˮ�¶�һ��ʱ��������CO2Ũ�����ӣ���ˮ���ܽ��CO2��֮������CO32-Ũ�Ƚ��� |
| C����������CO2Ũ��ȷ��ʱ����ˮ�¶�Խ�ߣ�CO32-Ũ��Խ�� |
| D��������CO2��������ʱ����ˮ�е�ɺ���������ܽ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 3 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ڼ�������Һ�зֱ���뱥��Na2SO4��CuSO4��Һ�������������������� |
| B��˾ĸ�춦����Զ���װ塢�л�������ԭ�������ںϽ� |
| C��������ά��̼��ά�����ά�������л��߷��Ӳ��� |
| D��ʯ�������ȷֽ�����˿���ʹ���Ը��������Һ��ɫ��ϩ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����������Ũ������ȷ�Ӧ���Եõ����� |
| B��������NaAlSiO4?nH2O�ɸ�д����������ʽΪ��Na2O?Al2O3?2SiO2?2nH2O |
| C��ij��ˮ��Ʒ�ɼ������һ��ʱ�䣬pH��4.68��Ϊ4.28������Ϊˮ���ܽ��˽϶��CO2 |
| D��Al65Cu23Fe12��һ���⾧�����кϽ�������������ܣ���Ӳ�ȱȽ���A1��Cu��Fe���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��FeSO4 |
| B��ZnSO4 |
| C��KNO3 |
| D��NaCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��2 | B��3 | C��4 | D��5 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com