
| A. | 2n+3-m | B. | a+2-m | C. | n+m+a | D. | a+2n+2-m |
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ | B. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | ||
| C. | 2MgO$\frac{\underline{\;电解\;}}{\;}$2Mg+O2↑ | D. | 2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
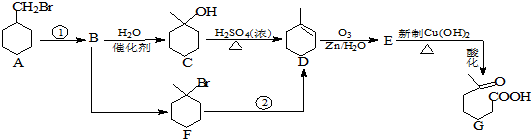
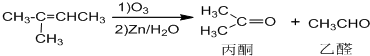
 +NaOH+2Cu(OH)2$\stackrel{加热}{→}$
+NaOH+2Cu(OH)2$\stackrel{加热}{→}$ +Cu2O↓+3H2O.
+Cu2O↓+3H2O.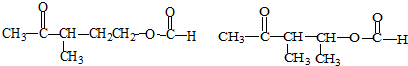
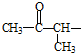 ②属于酯类 ③能发生银镜反应
②属于酯类 ③能发生银镜反应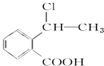 为原料制备
为原料制备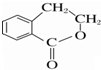 的合成路线流程图(无机试剂任用),并注明反应条件.
的合成路线流程图(无机试剂任用),并注明反应条件.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 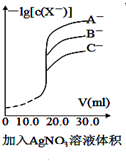 用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均可以与Ag+反应生成沉淀),由图可确定首先沉淀的是C- | |
| B. | 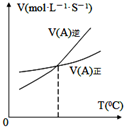 图表示反应中某反应物的正、逆反应速率随温度变化情况,由图可知该反应的正反应是吸热反应 | |
| C. | 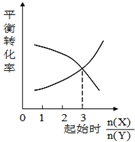 一定条件下,X和Y反应生成Z,由图1推出该反应的方程式可表示为:X+3Y?Z | |
| D. | 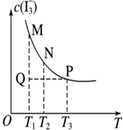 图表示溶液中反应:I2+I-?I3- 平衡c(I3-)随温度变化,反应速度V(正)M<V(逆)N |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
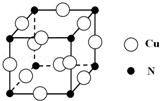 硼和氮元素在化学中有很重要的地位,回答下列问题:
硼和氮元素在化学中有很重要的地位,回答下列问题: .预计于2017年发射的“嫦娥五号”探测器采用的长征5号运载火箭燃料为偏二甲肼[(CH3)2NNH2].(CH3)2NNH2中N原子的杂化方式为sp3.
.预计于2017年发射的“嫦娥五号”探测器采用的长征5号运载火箭燃料为偏二甲肼[(CH3)2NNH2].(CH3)2NNH2中N原子的杂化方式为sp3.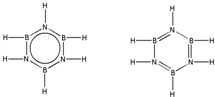 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| … | W | ||
| X | Y | … | Z |
| A. | 离子半径:X>Y>Z>W | |
| B. | 气态氢化物的稳定性W>Z | |
| C. | 元素X与Z形成的化合物中只含有离子键 | |
| D. | 最高价氧化物对应水化物的碱性X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O | B. | 2NaOH+CuSO4═Na2SO4+Cu(OH)2↓ | ||
| C. | 2CO+O2═2CO2 | D. | 2Al+2NaOH+2H2O═2NaAlO2+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 第Ⅱ步的离子方程式为Na++NH3+H2O+CO2→NaHCO3↓+NH4+ | |
| B. | 第Ⅲ步得到的晶体是Na2CO3•10H2O | |
| C. | A气体是CO2,B气体是NH3 | |
| D. | 第Ⅳ步操作的过程主要有溶解、蒸发、结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 酸碱中和滴定是中学化学中重要的定量实验之一.某研究性学习小组准确进行了如下实验,称取1.00g不纯的苛性钠样品配成250ml溶液,取出10.00ml,用已知浓度为0.040mol•L-1的盐酸进行滴定(杂质不与盐酸反应).
酸碱中和滴定是中学化学中重要的定量实验之一.某研究性学习小组准确进行了如下实验,称取1.00g不纯的苛性钠样品配成250ml溶液,取出10.00ml,用已知浓度为0.040mol•L-1的盐酸进行滴定(杂质不与盐酸反应).| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗盐酸溶液的体积(mL) | 20.05 | 20.00 | 22.10 | 19.95 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com