
| A.原子半径:Na>Mg>Al>H |
| B.热稳定性: HC l<H2S<PH3 |
| C.酸性强弱:H2SiO3<H2CO3<H3PO4 |
| D.氧化性:K+<Na+<Mg2+<Al3+ |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
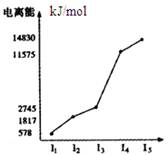
| A.X元素显+4价 |
| B.X为非金属 |
| C.X为第五周期元素 |
| D.X与氯反应时最可能生成的阳离子为X3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| W | X | |
| | Y | Z |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.元素X的最高价氧化物对应的水化物的酸性比Z的弱 |
| B.元素Y、Z的简单离子的电子层结构相同 |
| C.元素W与Z形成的化合物为共价化合物 |
| D.原子半径由大到小的顺序为:r(Z)>r(Y)>r (W) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 粒子轰击极簿的金箔。为了解释实验结果,提出了原子的核式结构学说。下列图中,黑点表示金原子核的位置,曲线ab、cd和ef表示经过金原子核附近的
粒子轰击极簿的金箔。为了解释实验结果,提出了原子的核式结构学说。下列图中,黑点表示金原子核的位置,曲线ab、cd和ef表示经过金原子核附近的 粒子的运动轨迹,能正确反映实验结果的图是( )
粒子的运动轨迹,能正确反映实验结果的图是( )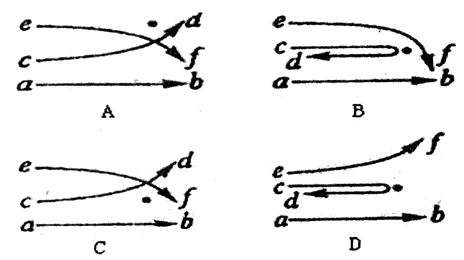
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.金属间发生的置换反应 |
| B.金属元素的最高价氧化物对应水化物的碱性强弱 |
| C.金属元素的单质与水或酸反应置换出氢气的难易 |
| D.每摩尔金属单质在反应中失去电子数目的多少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com