
【题目】已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C、F是无色无味的气体,H是白色沉淀,W溶液中滴加KSCN溶液出现红色。
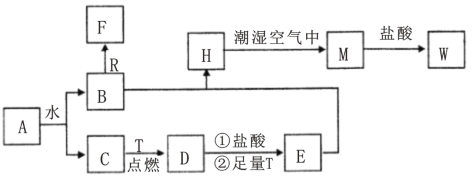
(1)物质D的化学式为___________,E化学式为___________;
(2)点燃气体F前必须先_________________________;
(3)H在潮湿空气中变成M的实验现象是_______________,化学方程式为_______________,其反应类型是 反应(填基本反应类型)。
(4)B和R在溶液中反应生成F的离子方程式为____________________,该反应属 反应 (填基本反应类型)。
【答案】(1)Fe3O4(1分)FeCl2(1分)
(2)检验气体纯度(1分)(3)白色沉淀迅速变为灰绿色,最终变为红褐色。(1分)
4Fe(OH)2+2H2O+O2==4Fe(OH)3(2分)化合(1分)
(4)2Al+2OH-+2H2O=2AlO2-+3H2↑(2分)置换(1分)
【解析】
试题分析:已知A为淡黄色固体,能和水反应生成B和C,则A是过氧化钠。R是地壳中含量最多的金属元素的单质,R是Al,T为生活中使用最广泛的金属单质,T是铁,D是具有磁性的黑色晶体,C、F是无色无味的气体,H是白色沉淀,W溶液中滴加KSCN溶液出现红色,所以C是氧气,D是四氧化三铁,B是氢氧化钠,F是氢气。E是氯化亚铁,H是氢氧化亚铁,M是氢氧化铁,W是氯化铁
(1)物质D的化学式为Fe3O4,E化学式为 FeCl2;
(2)点燃气体氢气前必须先检验气体纯度;
(3)H在潮湿空气中变成M的实验现象是白色沉淀迅速变为灰绿色,最终变为红褐色,化学方程式为4Fe(OH)2 + 2H2O + O2 == 4 Fe(OH)3,其反应类型是化合反应。
(4)B和R在溶液中反应生成F的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,该反应属于置换反应。


科目:高中化学 来源: 题型:
【题目】在稀硫酸和稀硝酸的混合溶液中,加入铜粉。
(1)若将100mL 2mol/L HNO3和100mL 1mol/L H2SO4混合后,加入19.2g 铜粉,微热,充分反应。
①若忽略溶液体积变化,溶液中铜离子物质的量浓度为 mol/L
②生成气体折合成标准状况下体积 L;
③若使铜粉全部溶解,还需加入1mol/L H2SO4 mL
(2)若c(SO![]() )+c(NO
)+c(NO![]() )=5.0 mol·L-1。取200 mL该混合酸,则能溶解铜的最大质量为 g
)=5.0 mol·L-1。取200 mL该混合酸,则能溶解铜的最大质量为 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O = 2Mg (OH)2 下列关于该电池的说法错误的是

A.Mg电极的电极反应式:Mg-2e-=Mg2+
B.这种电池的工作原理可以认为是镁的吸氧腐蚀
C.活性炭电极上发生氧化反应
D.电池工作时实现了化学能向电能的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
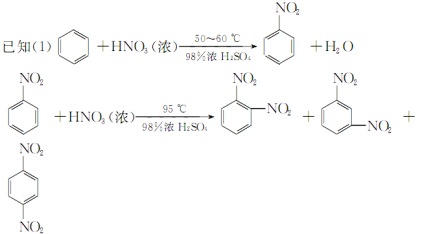
【题目】硝基苯是重要的精细化工原料,是医药和染料的中间体,还可作有机溶剂。制备硝基苯的过程如下:
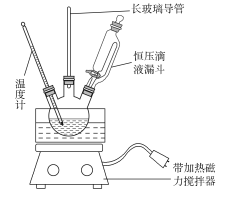
①组装如下图反应装置。配制混酸,取100 mL烧杯,用20 mL 浓硫酸与18 mL浓硝酸配制混酸,加入漏斗中,把18 mL 苯加入三颈烧瓶中。
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀。
③在50~60 ℃下发生反应,直至反应结束。
④除去混酸后,粗产品依次用蒸馏水和10% Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品。
(2)可能用到的有关数据列表如下:
物 质 | 熔点/℃ | 沸点/℃ | 密度(20 ℃) /(g·cm-3) | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
1,3-二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
浓硝酸 | — | 83 | 1.4 | 易溶于水 |
浓硫酸 | — | 338 | 1.84 | 易溶于水 |
请回答下列问题:
(1)配制混酸应在烧杯中先加入________。
(2)恒压滴液漏斗的优点是__________________________________。
(3)实验装置中长玻璃导管可用________代替(填仪器名称)。
(4)反应结束后产品在液体的________层(填“上”或“下”),分离混酸和产品的操作方法为________________________________。
(5)用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净? __________________________。
(6)为了得到更纯净的硝基苯,还需先向液体中加入____________除去水,然后蒸馏。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将2molSO2和1molO2充入一固定容积的密闭容器中,在催化剂作用下发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) △H=-197kJ/mol,当达到化学平衡时,下列说法中正确的是
2SO3(g) △H=-197kJ/mol,当达到化学平衡时,下列说法中正确的是
A.SO2和SO3共2mol B.生成 SO32mol
C.放出197kJ热量 D.含氧原子共8mo1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质
B. HClO是弱酸,所以NaClO是弱电解质
C. HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物
D. 杂多酸盐Na2HPW12O40与Na3PW12O40都是强电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列区别物质的方法错误的是( )
A.铝与铝合金﹣比较硬度
B.用水区别氯化钠和硝酸铵固体
C.用燃烧的方法区别羊毛和涤纶
D.用燃着的木条鉴别氮气与二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
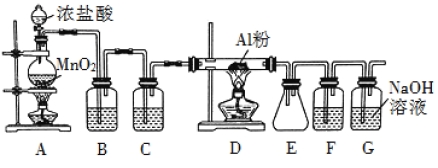
【题目】氯气在工业上有着重要的用途,某兴趣小组在实验室中用下列装置模拟工业上用氯气制备无水氯化铝(183℃时升华,遇潮湿空气即产生大量白雾)。
请回答下列问题:
(1)装置 B 中盛放饱和食盐水,其作用是 。F 中盛放的是 ,其作用是 。用一件仪器装填适当试剂后也可起到 F 和 G 的作用,所装填的试剂为 。
(2)装置 A 实验开始时,先检查装置气密性,接下来的操作依次是 (填序号)。
A.往烧瓶中加入 MnO2 粉末 B.加热 C.往烧瓶中加入浓盐酸
(3)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学 提出很多实验方案,其中方案之一为让残留的液体与足量 Zn 反应,测量生成的 H2体积。 装置如图所示(夹持器具已略去)。反应完毕,每间隔 1 分钟读取气体体积、气体体积逐渐减小,直至不变。气体体积逐次减小的原因是 (排除仪器和实验操作的影响因素)。
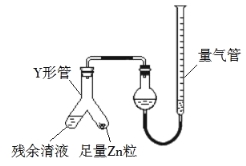
(4)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量 ClO2 生成;ClO2 沸点为 10 ℃,熔点为59 ℃,液体为红色;Cl2 沸点为34 ℃,液态为黄绿色。设计最简单的实验验证 Cl2中含有 ClO2: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z三种元素,X、Z的单质在常温下为气体,Z的单质为黄绿色气体。X的单质可以在Z的单质中燃烧,火焰呈苍白色,生成XZ,XZ极易溶于水,在水中电离出X+和Z-,其水溶液能使蓝色石蕊试纸变红。Y是一种常温下能与水反应的金属,加热时,Y在空气中燃烧,可以生成淡黄色固体M。
(1)试写出元素符号:X______、Z______。在实验室,少量Y通常保存在______里。
(2)写出下列反应的离子方程式:实验室制Z的反应___________________;
M与水反应___________________;
(3)实验室制取Z的单质时,为了防止其污染空气,通常用____(填化学式)溶液吸收尾气。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com