
| A. | 酸雨形成的主要原因是大量石油、煤等矿物燃料的燃烧 | |
| B. | 反应物的总能量高于生成物的总能量时,反应放热 | |
| C. | 原电池是化学能转变为电能的一种装置 | |
| D. | 在铜、锌和稀硫酸构成的原电池中,铜是负极 |
分析 A.大量石油、煤等矿物燃料的燃烧,排放大量的二氧化硫;
B.反应物的总能量高于生成物的总能量时,反应放出热量;
C.原电池将化学能转化为电能;
D.铜、锌和稀硫酸构成的原电池中,Zn失去电子,作负极.
解答 解:A.大量石油、煤等矿物燃料的燃烧,排放大量的二氧化硫,为酸雨的主要成因,故A正确;
B.反应物的总能量高于生成物的总能量时,反应放出热量,则该反应为放热反应,故B正确;
C.原电池是化学能转化为电能的装置,能量转化时可能伴随热能等,故C正确;
D.铜、锌和稀硫酸构成的原电池中,Zn失去电子,作负极,而Cu为正极,故D错误;
故选D.
点评 本题考查反应热与焓变、能量转化等,为高频考点,把握反应中能量变化、能量转化为解答的关键,侧重分析与应用能力的考查,注意化学与生活的联系,题目难度不大.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
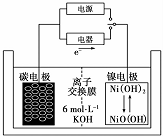 一种二次电池如图所示,该电池的电解质为强碱溶液,下列说法中正确的是( )
一种二次电池如图所示,该电池的电解质为强碱溶液,下列说法中正确的是( )| A. | 充电时阴极发生氧化反应 | |
| B. | 充电时将碳电极与电源的正极相连 | |
| C. | 放电时碳电极反应为原电池的负极 | |
| D. | 放电时镍电极反应为Ni(OH)2-e-+OH-=NiO(OH)+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1+Q2+Q3 | B. | 0.5Q3-Q2+2Q1 | C. | Q3-2Q2+4Q1 | D. | 0.5(Q1+Q2+Q3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -48.5kJ/mol | B. | +48.5kJ/mol | C. | -45.5kJ/mol | D. | +45.5kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
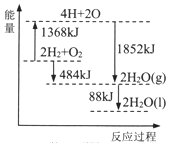
| A. | 拆开2molH2(g)和1 molO2(g)中的化学键,共放出1368 kJ能量 | |
| B. | 1 molH2和0.5molO2的能量之和比1 molH2O(1)的能量大242 kJ | |
| C. | 2H2O(g)=2H2(g)+O2(g)△H=+484KJ/mol | |
| D. | 2H2(g)+O2(g)=2H2O(1)△H=572KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入硝酸银溶液产生白色沉淀,一定有Cl- | |
| B. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05mol | B. | 0.025mol | C. | 4.9g | D. | 9.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78g过氧化钠中含2NA个O2- | |
| B. | 0.1molOH-含NA个电子 | |
| C. | 1.8g重水(D2O)中含NA个中子 | |
| D. | 标准状况下11.2L臭氧中含NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9 g超重水(3H216O)含中子数为6NA | |
| B. | 标准状况下,22.4 L CCl4含有的分子数目为NA | |
| C. | 常温常压下,16g甲烷中共价键数目为4NA | |
| D. | 1 L 0.1 mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com