
| A. | 一定温度下,向CH3COOH溶液中通HCl气体,对该反应的平衡常数无影响 | |
| B. | 0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小 | |
| C. | CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动 | |
| D. | 常温下pH=2的CH3COOH与pH=12的NaOH溶液等体积混合后,溶液的pH<7 |
分析 A.通入HCl,氢离子浓度增大,电离平衡CH3COOH?H++CH3COO-逆向移动,Ka与温度有关;
B.加水稀释,促进电离,但氢离子浓度减小;
C.加少量的CH3COONa固体,醋酸根离子浓度增大;
D.常温下pH=2的CH3COOH与pH=12的NaOH溶液等体积混合后,醋酸过量,为醋酸与醋酸钠的混合溶液.
解答 解:A.通入HCl,氢离子浓度增大,电离平衡CH3COOH?H++CH3COO-逆向移动,Ka与温度有关,温度不变,则反应的平衡常数无影响,故A正确;
B.加水稀释,促进电离,但氢离子浓度减小,Kw均不变,则溶液中c(OH-)增大,故B错误;
C.加少量的CH3COONa固体,醋酸根离子浓度增大,则平衡逆向移动,故C正确;
D.常温下pH=2的CH3COOH与pH=12的NaOH溶液等体积混合后,醋酸过量,为醋酸与醋酸钠的混合溶液,则溶液的pH<7,故D正确;
故选B.
点评 本题考查弱电解质的电离平衡,为高频考点,把握电离平衡的移动、K的影响因素、酸碱混合为解答的关键,侧重分析与应用能力的考查,注意平衡移动原理的应用,题目难度不大.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
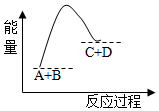
| A. | 该反应的能量变化表现为释放能量 | |
| B. | 该反应中反应物A、B的总能量小于生成物C 的能量 | |
| C. | 该反应的能量变化是将化学能转化为热能、电能等其它形式 | |
| D. | 该反应能量变化的实质是旧化学键断裂和新化学键形成的结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2+H2O→H2SO3 | B. | Cl2+H2O→HCl+HClO | ||
| C. | 2F2+2H2O→4HF+O2 | D. | 2Na+2H2O→2NaOH+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁在碱性条件下发生电化学腐蚀的正极反应是:O2+2H2O+4e-=4OH- | |
| B. | 当镀铜铁制品的镀层破损时,镀层仍能对铁制品起保护作用 | |
| C. | 在船舶外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 | |
| D. | 为保护地下钢管不被腐蚀可将钢管与外加直流电源的负极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使紫色石蕊试液变红 | B. | 易溶于水 | ||
| C. | 发生酯化反应 | D. | 无色无味 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的催化重整、煤的干馏均可以得到芳香烃 | |
| B. | 乙酸、草酸均不能使酸性高锰酸钾溶液褪色 | |
| C. | 新戊烷的所有碳原子位于同一平面 | |
| D. | 奶油、鸡蛋清均属于高分子化合物且均能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
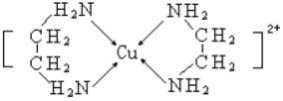
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com