
【题目】以CH4、CO2为原料合成乙酸,是综合开发温室气体资源的新方向。
I.CH4.CO2催化重整间接制乙酸
CH4、CO2催化重整制合成气,再利用合成气制乙酸,涉及的反应如下:
反应l:CH4(g)+CO2(g) 2H2(g)+2CO(g)△H
反应2:2H2(g)+CO(g) CH3OH(g)△H=-90.9kJ·mol-1
反应3:CH3OH(g)+CO(g) CH3COOH(g)△H=-118.2kJ·mol-1
(1)已知:CH4(g)+CO2(g) CH3COOH(g)△H=+37.9kJ·mol-1则“反应l”的△H=_________
(2)“反应1”的化学反应速率v=k[![]() ]m·[
]m·[![]() ]n,k为速率常数。1123K和1173K时,分别保持
]n,k为速率常数。1123K和1173K时,分别保持![]() 或
或![]() 不变,测得速率v与
不变,测得速率v与![]() 、
、![]() 的关系如图所示:
的关系如图所示:

①由图可知,下列叙述正确的是_________(填标号)。
A.当10kPa≤![]() ≤25kPa时,m=l
≤25kPa时,m=l
B.其他条件不变,增大![]() ,速率v不一定增大
,速率v不一定增大
C.a、b、c三点速率常数的大小关系为:ka>kb>kc
②若初始时按n(CH4):n(CO2)=1:1进气,且Kb=1.3×10-2mol·g-1·s-1·Kpa-2,则b点的化学反应速率v=_________mol·g-1·s-1。
(3)向盛有催化剂的刚性容器中通入等物质的量的CH4(g)和CO2(g),发生“反应1”。在923K和1173K时,CH4(g)的转化率(α)与时间(t)的关系如图所示。

923K时,CH4(g)的平衡转化率α=_________,若平衡时体系的总压强为p0,平衡常数K923K=____(用含有p0的代数式表示)。
II.CH4、CO2两步法制乙酸
(4)反应CH4(g)+CO2(g)CH3COOH(g)不能自发进行。将该反应拆分成两个连续的步骤进行,可在较温和的条件下实现上述转化,具体过程:

①第二步反应的化学方程式为_________
②为增大CH3COOH的平衡产率,从温度角度考虑,第一步反应在高温下进行,第二步反应在_________进行;从H2浓度的角度考虑,应采取的措施是_________。
【答案】+247.0kJ·mol1 AB 5.2 60% ![]() p02或1.265625 p02 CO2+Co3C+2H2CH3COOH+3Co 低温 第一步减小氢气的浓度(或压强),第二步增大氢气的浓度(或压强)
p02或1.265625 p02 CO2+Co3C+2H2CH3COOH+3Co 低温 第一步减小氢气的浓度(或压强),第二步增大氢气的浓度(或压强)
【解析】
I.利用该盖斯定律进行计算,将反应1、反应2、反应3相加可以得到总反应,可以求出“反应l”的△H的数值;从图像信息分析m的值,k的值和速率的变化;
II.根据图示可以写出化学反应方程式。从化学平衡移动的方向分析浓度,温度对平衡的影响。
I.(1)反应l:CH4(g)+CO2(g)2H2(g)+2CO(g)△H1
反应2:2H2(g)+CO(g) CH3OH(g)△H2=-90.9kJ·mol-1
反应3:CH3OH(g)+CO(g) CH3COOH(g)△H3=-118.2kJ·mol-1
总反应:CH4(g)+CO2(g) CH3COOH(g)△H=+37.9kJ·mol-1,根据盖斯定律,反应l+反应2+反应3可得总反应,△H1+△H2+△H3=△H,则△H1=△H-△H2-△H3=+37.9kJ·mol-1-(-90.9kJ·mol-1)-(-118.2kJ·mol-1)=+247.0kJ·mol1;
(1)①A.当10kPa≤![]() ≤25kPa时,由左图的速率随甲烷的分压变化图可知,图像为一条直线,故斜率为1,则m=l,故A正确;
≤25kPa时,由左图的速率随甲烷的分压变化图可知,图像为一条直线,故斜率为1,则m=l,故A正确;
B.由右图的速率随甲烷的分压变化图可知,其他条件不变,增大![]() ,在
,在![]() 的值为25 Kpa时,速率值不再发生变化,故速率v不一定增大,故B正确;
的值为25 Kpa时,速率值不再发生变化,故速率v不一定增大,故B正确;
C.由图像可知,va>vb>vc, a和b的![]() 相等、根据公式,v=k[
相等、根据公式,v=k[![]() ]m·[
]m·[![]() ]n,由于va>vb ,ka>kb,三个点中c点
]n,由于va>vb ,ka>kb,三个点中c点![]() 值最小,故无法得出c点速率常数最小关系,故C错误;
值最小,故无法得出c点速率常数最小关系,故C错误;
答案选AB;
②若初始时按n(CH4):n(CO2)=1:1进气,则b点的化学反应速率v= k[![]() ]m·[
]m·[![]() ]n,已知Kb=1.3×10-2mol·g-1·s-1·Kpa-2,CH4(g)+CO2(g)2H2(g)+2CO(g),由图像可知,当10kPa≤
]n,已知Kb=1.3×10-2mol·g-1·s-1·Kpa-2,CH4(g)+CO2(g)2H2(g)+2CO(g),由图像可知,当10kPa≤![]() ≤25kPa时,m=l,n=1, vb= kb[20]·[20] =1.3×10-2mol·g-1·s-1·Kpa-2×400=5.2 mol·g-1·s-1;
≤25kPa时,m=l,n=1, vb= kb[20]·[20] =1.3×10-2mol·g-1·s-1·Kpa-2×400=5.2 mol·g-1·s-1;
(3) 反应l:CH4(g)+CO2(g)2H2(g)+2CO(g)△H>0,正反应放热,升高温度,反应正向移动,CH4(g)的转化率增大,则平衡时CH4(g)的转化率为98%的曲线为1173K时的平衡曲线,60%的为温度923K时的平衡曲线,由曲线可知,923K时,CH4(g)的平衡转化率α=60%,若平衡时体系的总压强为p0,设CH4和CO2的初始投入物质的量为1mol,923K平衡时时,CH4(g)的平衡转化率α=60%,列“三段式”:
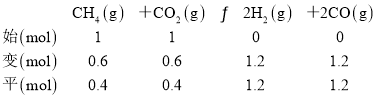
平衡常数K923K=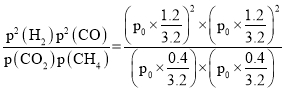 =
=![]() p02或1.265625 p02;
p02或1.265625 p02;
II.(4)①根据图示,第二步反应的化学方程式为CO2+Co3C+2H2CH3COOH+3Co;
②根据图示可知,第二步反应为放热反应,增大CH3COOH的平衡产率,即反应向正向移动,降低温度反应向放热的方向进行,从温度角度考虑,第二步反应在低温下进行;从H2浓度的角度考虑,反应一中氢气为生成物,使反应正向进行,则应该减小氢气的浓度(或压强),对于反应二,氢气为反应物,可增大氢气的浓度(或压强),促使平衡正向移动,使CH3COOH的平衡产率增大。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图是温度和压强对反应X+Y![]() 2Z影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
2Z影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
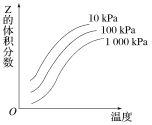
A.上述可逆反应的正反应为放热反应B.X、Y、Z均为气态
C.X和Y中最多只有一种为气态,Z为气态D.上述反应的逆反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应:2A![]() B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
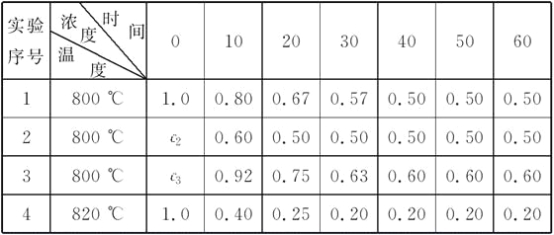
根据上述数据,完成下列填空:
(1)在实验1中,反应在10至20 min时间内A的平均速率为________mol·L-1·min-1。
(2)在实验2中,A的初始浓度c2=__________mol·L-1,反应经20 min就达到平衡,可推测实验2中还隐含的条件是
________________________________________________________________________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3________v1(填“>”、“=”或“<”),且c3________1.0 mol·L-1(填“>”、“=”或“<”)。
(4)比较实验4和实验1,可推测该反应是________反应(选填“吸热”或“放热”)。理由是
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:

供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作①的名称是________,操作②的名称是____________。
(2)试剂a是____________(填化学式,下同),试剂b是__________,固体B是____________。
(3)加入试剂a所发生反应的化学方程式为__________________________________。
加入试剂b所发生反应的化学方程式为____________________________________。
(4)该方案能否达到实验目的:__________________________(填“能”或“不能”)。若不能,应如何改进?(若能,此问不用回答)__________。
(5)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是____的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气相条件下,立方烷能自发地发生热重排反应生成一系列化合物。下列说法正确的是
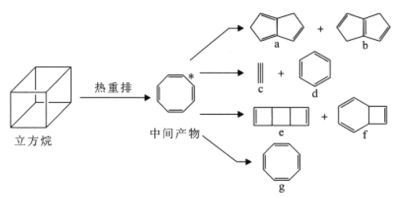
A.a、f中所有原子均可处于同一平面
B.1mol化合物e完全燃烧消耗12molO2
C.六硝基立方烷最多有3种结构(不考虑立体异构)
D.立方烷热重排产物均能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷可作抗爆剂的添加剂。如图为实验室制备1,2-二溴乙烷的装罝图, 图中分液制斗和烧瓶a中分别装有浓H2SO4和无水乙醇,d装罝试管中装有液溴。
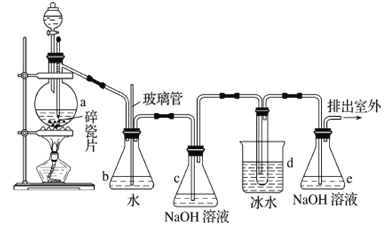
己知:CH3CH2OH![]() CH2=CH2↑+H2O;2CH3CH2OH
CH2=CH2↑+H2O;2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
相关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
状态 | 无色液体 | 无色液体 | 无色液体 | 红棕色液体 |
密度/g·cm-3 | 0.79 | 2.18 | 0.71 | 3.10 |
沸点/℃ | 78.5 | 131.4 | 34.6 | 58.8 |
熔点/℃ | -114.3 | 9.79 | - 116.2 | -7.2 |
水溶性 | 混溶 | 难溶 | 微溶 | 可溶 |
(1)实验中应迅速将温度升卨到170℃左右的原因是______________________________。
(2)安全瓶b在实验中有多重作用。其一可以检查实验进行中d装罝中导管是否发生堵塞,
请写出发生堵塞时瓶b中的现象:①_______________________________;如果实验时d装罝中导管堵塞,你认为可能的原因是②_______________________________________________;安全瓶b还可以起到的作用是③__________________。
(3)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是_______________________________。
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正确情况下超过许多,如果装罝的气密性没有问题,试分析可能的原因:______________、______________(写出两条即可)。
(5)除去产物中少量未反应的Br2后,还含有的主要杂质为___________,要进一步提纯,下列操作中必需的是_____________ (填字母)。
A.重结晶 B.过滤 C.萃取 D.蒸馏
(6)实验中也可以撤去d装罝中盛冰水的烧杯,改为将冷水直接加入到d装罝的试管中,则 此时冷水除了能起到冷却1,2-二溴乙烷的作用外,还可以起到的作用是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)是具有紫色光泽的粉末,是一种高效绿色强氧化剂,碱性条件下稳定,可用于废水和生活用水的处理。实验室以石墨和铁钉为电极,以不同浓度的NaOH溶液为电解质溶液,控制一定电压电解制备高铁酸钠,电解装置和现象如下:
c(NaOH) | 阴极现象 | 阳极现象 |
1 mol·L-1 | 产生无色气体 | 产生无色气体,10min内溶液颜色无明显变化 |
10 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,3min后溶液变为浅紫红色,随后逐渐加深 |
15 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,1min后溶液变为浅紫红色,随后逐渐加深 |
下列说法不正确的是

A. a为铁钉,b为石墨
B. 阴极主要发生反应:2H2O + 2e-=== H2↑+ 2OH-
C. 高浓度的NaOH溶液,有利于发生Fe-6e-+ 8OH-=== FeO42-+ 4H2O
D. 制备Na2FeO4时,若用饱和NaCl溶液,可有效避免阳极产生气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的两份锌粉a、b,分别加入两支相同的试管中,然后加入等体积等物质的量浓度且均过量的稀硫酸,同时向a中加入少量CuSO4溶液,则产生氢气的体积(V)与时间(t)的关系用图像表示如下,其中正确的是( )
A. 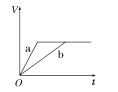 B.
B. 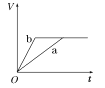 C.
C. 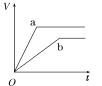 D.
D. 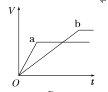
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制氯气的装置。
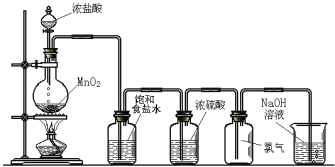
圆底烧瓶中发生反应的化学方程式为_____________________,生成1个Cl2分子转移电子数目为________个,饱和食盐水的作用是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com