
| 选项 | 实验操作 | 实验结论 |
| A | 向盛有少量AgNO3溶液的试管中滴加NaCl溶液至不再有沉淀生成,再向其中滴加NaI溶液,白色沉淀逐渐变为黄色 | AgCl的溶解度大于AgI |
| B | 向某溶液中加入2滴KSCN溶液,溶液颜色没变化;再加入几滴新制的氯水,溶液变为红色 | 溶液中一定含有Fe2+ |
| C | 向某溶液中加入稀硝酸后,再向其中加入BaCl2溶液,产生白色沉淀 | 该溶液中一定含有SO42- |
| D | 组装如下装置,电流表中均有电流通过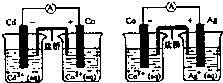 |
金属活动性:Cd>Co>Ag |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(2011?海淀区二模)根据下列图示的实验操作,不能够实现实验目的是( )
|
查看答案和解析>>
科目:高中化学 来源: 题型:
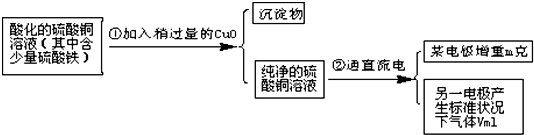

| ||
| ||
| 11200m |
| V |
| 11200m |
| V |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市闵行区高三下学期三模考试化学试卷(解析版) 题型:实验题
对实验过程中出现的异常现象进行探究,是实施素质教育、培养创新精神的有效途经。
【实验1】用下图实验装置进行铜与浓硫酸的反应,实验中发现试管内除了产生白色硫酸铜固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有黑色的CuO、CuS、Cu2S。查阅资料:CuS和Cu2S均为黑色固体,常温下都不溶于稀盐酸,在空气中煅烧,均转化为CuO和SO2。为了探究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如下实验:
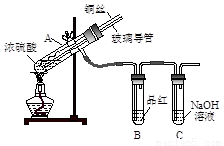
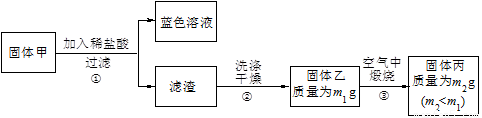
(1)上述实验装置除了有尾气吸收装置外,还有一个显著的优点是 。
(2)固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有 。
(3)确定乙是否煅烧完全的操作是 。
(4)煅烧过程中一定发生的化学反应方程式为 。
【实验2】某化学兴趣小组设计了如下实验装置(尾气吸收装置未画出),探究Cl2、Br2、Fe3+的氧化性强弱。
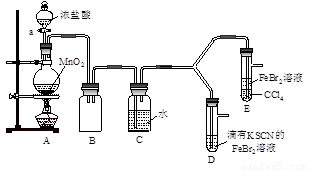
(5)根据下列实验操作和现象,填写实验结论。
|
实验操作 |
实验现象 |
结论 |
|
打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 |
D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,CCl4层无明显变化。 |
Cl2、Br2、Fe3+的氧化性由强到弱的顺序为:
|
(6)因忙于观察和记录,没有及时停止反应,D、E中均发生了异常的变化:D装置中,红色慢慢褪去;E装置中,CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
|
ⅰ.(SCN)2性质与卤素单质类似。氧化性:Cl2>(SCN)2 。 ⅱ.Cl2和Br2反应生成的BrCl呈红色,沸点约5℃,与水发生水解反应。 ⅲ.AgClO、AgBrO均可溶于水。 |
①请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因____ ;
请设计简单实验证明上述解释 。
②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com