
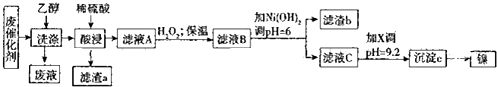
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
分析 用乙醇洗涤溶解并除去有机物杂质,“酸浸”时主要是溶解镍金属和铁、Al单质,只有SiO2不与硫酸反应,过滤得到滤渣a是SiO2;滤液A加入H2O2的目的是将Fe2+氧化为Fe3+,B溶液调节pH=6,使溶液中Fe3+、Al3+转化为氢氧化铁、氢氧化铝沉淀,通过过滤而除去,由表中数据,加入试剂X的目的是将镍转化为Ni(OH)2,故X是碱类物质;Ni(OH)2转化为单质镍的方法是先将其加热使其转化为NiO,然后用还原剂进行还原,如通过铝热反应.
(1)利用蒸馏的方法可将乙醇与其它有机物分离开;
(2)将废催化剂粉碎或适当地提高硫酸的浓度、浸泡时的温度均可提高酸浸速率;
(3)加入H2O2的目的是将Fe2+氧化为Fe3+.由表中数据及流程图知,加入试剂X的目的是将镍转化为Ni(OH)2,故X是碱类物质;
(4)Ni(OH)2转化为单质镍的方法是先将其加热使其转化为NiO,然后用还原剂进行还原,可以通过铝热反应进行;
计算m kg废催化剂中含镍的质量,计算滤液B中的镍元素质量,根据化学式计算Ni(OH)2中含镍的质量,将每一步的损失率都转化为Ni的损失率,根据Ni元素守恒计算最终得到的单质镍;
(5)首先依得失电子守恒配平氧化剂与还原剂、氧化产物与还原产物的计量数得:2Ni2++H2PO2-→2Ni++H2PO3-+,再依电荷守恒、质量守恒知还有水参与反应并有H+生成;从能源消耗方面分析化学镀的优点.
解答 解:用乙醇洗涤溶解并除去有机物杂质,“酸浸”时主要是溶解镍金属和铁、Al单质,只有SiO2不与硫酸反应,过滤得到滤渣a是SiO2.滤液A加入H2O2的目的是将Fe2+氧化为Fe3+,B溶液调节pH=6,使溶液中Fe3+、Al3+转化为氢氧化铁、氢氧化铝沉淀,通过过滤而除去,由表中数据,加入试剂X的目的是将镍转化为Ni(OH)2,故X是碱类物质.Ni(OH)2转化为单质镍的方法是先将其加热使其转化为NiO,然后用还原剂进行还原,如通过铝热反应.
(1)用乙醇洗涤的目的是溶解并除去有机物杂质,利用蒸馏的方法可将乙醇与其它有机物分离开;因只有SiO2不与硫酸反应,故滤渣a是SiO2,
故答案为:SiO2;溶解、除去有机物;蒸馏;
(2)将废催化剂粉碎或适当地提高硫酸的浓度、浸泡时的温度均可提高酸浸速率,
故答案为:将废催化剂粉碎或适当地提高硫酸的浓度、浸泡时的温度;
(3)加入H2O2的目的是将Fe2+氧化为Fe3+,反应离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O,由表中数据及流程图知,加入试剂X的目的是将镍转化为Ni(OH)2,故X是碱类物质,X可以为NaOH,
故答案为:2Fe2++2H++H2O2=2Fe3++2H2O;NaOH;
(4)Ni(OH)2转化为单质镍的方法是先将其加热使其转化为NiO,然后用还原剂进行还原,可以通过铝热反应进行,反应方程式为:Ni(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$NiO+H2O、2Al+2NiO $\frac{\underline{\;高温\;}}{\;}$Al2O3+3Ni;
m kg废催化剂中含镍的质量为70% m kg,在经过洗涤及酸浸转化到滤液B中的镍元素为70%×97% m kg,a kg Ni(OH)2中含镍为 $\frac{59}{93}$a kg,根据Ni元素守恒,故最终得到的单质镍为(70%×97%m+$\frac{59}{93}$a)kg×95%,
故答案为:Ni(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$NiO+H2O、2Al+2NiO $\frac{\underline{\;高温\;}}{\;}$Al2O3+3Ni;(70%×97%m+$\frac{59}{93}$a)×95%;
(5)首先依得失电子守恒配平氧化剂与还原剂、氧化产物与还原产物的计量数得:2Ni2++H2PO2-→2Ni++H2PO3-+,再依电荷守恒、质量守恒知还有水参与反应并有H+生成,配平后的离子方程式为:2Ni2++H2PO2-+H2O=2Ni++1H2PO3-+2H+;
与电镀相比,化学镀的最大优点是:不消耗电能,节约能源,
故答案为:2、1、H2O→2、1、2H+;不消耗电能,节约能源.
点评 本题以工艺流程为载体,考查了物质分离提纯、化学反应速率影响因素、沉淀转化、化学计算、氧化还原反应配平等,是高考常考题型,综合性较强,涉及知识面较广,侧重考查学生对知识的迁移应用,关键是对工艺流程理解分析,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 中和10 mL 0.1 mol•L-1 醋酸与中和100 mL 0.01 mol•L-1的醋酸所需同种碱溶液的量不同 | |
| B. | 常温下,pH=3的甲酸溶液的c(H+)与pH=11的氨水溶液中,由水电离产生的c(OH-)相等 | |
| C. | 向NH4Cl溶液中逐渐加入适量NaOH固体,溶液的导电性明显增强 | |
| D. | 向饱和石灰水中加入少量CaO,恢复至室温后溶液中c(OH-)增大,导电能力增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池的总反应是:2C4H10+13O2+16OH-═8CO32-+18H2O | |
| B. | 在熔融电解质中,O2-移向负极 | |
| C. | 通入空气一极是负极,电极反应为:O2+4e-═2O2- | |
| D. | 通入丁烷一极是正极,电极反应为:C4H10+13O2--26e-═4CO2+5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在澄清透明的溶液中:H+、Na+、SO42-、Cu2+ | |
| B. | 在$\frac{{K}_{w}}{c(O{H}^{-})}$=1 mol•L-1的溶液中:Na+、NH4+、I-、CO32- | |
| C. | 在0.1mol•L-1NaHSO4溶液中:K+、Fe2+、C1-、NO3- | |
| D. | 在能使甲基橙显黄色的溶液中:Ca2+、Ba2+、Br-、C1- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com