

| A、甲能使酸性高锰酸钾溶液褪色 |
| B、乙能与溴水发生加成反应使溴水褪色 |
| C、丙分子中所有原子均在同一平面上 |
| D、丁在浓硫酸作用下可与乙酸发生取代反应 |


科目:高中化学 来源: 题型:
| A、H2SO3>I->Fe2+>NO |
| B、I->H2SO3>Fe2+>NO |
| C、Fe2+>I->H2SO3>NO |
| D、NO>Fe2+>H2SO3>I- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铅蓄电池在放电过程中,负极质量减小,正极质量增加 |
| B、设想把“H2+Cl2═2HCl”设计成燃料电池,用于工业制盐酸,并进行发电 |
| C、纯锌与稀硫酸反应产生氢气的速率较慢,再加入少量CuSO4固体,速率不变 |
| D、原电池的两极一定是由活泼性不同的两种金属组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 )的单体.某课题组用有机物A(分子式C4H9Br,分子中有3个甲基)和甲醇为有机原料合成H.合成路线如下:
)的单体.某课题组用有机物A(分子式C4H9Br,分子中有3个甲基)和甲醇为有机原料合成H.合成路线如下:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
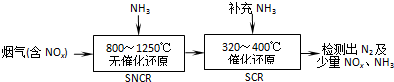
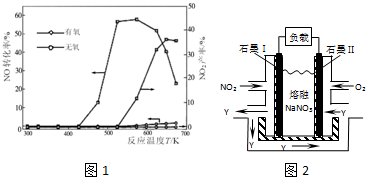
查看答案和解析>>
科目:高中化学 来源: 题型:
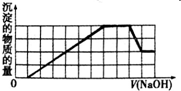 某溶液中可能含有H+、NH4+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示.下列说法正确的是( )
某溶液中可能含有H+、NH4+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示.下列说法正确的是( )| A、原溶液中含有的阳离子只有H+、Fe3+、Al3+ |
| B、原溶液中一定含有SO42-和Na+ |
| C、原溶液中含有的Fe3+和Al3+的物质的量之比为l:l |
| D、反应最后形成的溶液中溶质只有Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CH2═CH-CH3+HCl
| |||
B、CH3CHO+H2
| |||
C、CH3CH2Br+NaOH
| |||
| D、CH≡CH+2Br2-→CH Br2CH Br2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com