
分析 发生反应:CH3COOH+NaOH═CH3COONa+H2O,根据方程式计算10mL食醋样品中醋酸的质量,可以得到总酸含量进而判断是否符合标准.
解答 解:设10ml食醋样品中醋酸的质量为 x,则:
CH3COOH+NaOH═CH3COONa+H2O
60 40
x 7.5g×4%
$\frac{60}{x}$=$\frac{40}{7.5g×4%}$
解之得:x=0.45g
则该食醋的总酸含量为4.5g/100ml,
答:该食醋的总酸含量符合国家标准.
点评 本题以判断食醋酸总酸含量是否符合标准为载体,考查了化学方程式计算,注意醋酸是一种酸,电离时生成的阳离子也全是氢离子,其电离方程式为CH3COOH=CH3COO-+H+.


 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | <1:1 | C. | ≥1:1 | D. | 任意比 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
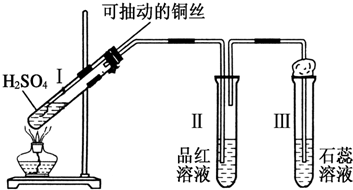
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
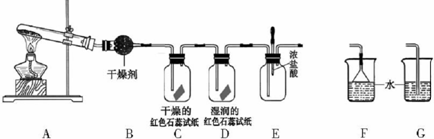
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入少量 HCl 气体 | B. | 加入少量 NaOH 固体 | ||
| C. | 加入少量 H2O | D. | 适当升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com