

| A. | 惰性电极A为阳极,惰性电极B为阴极 | |
| B. | 电解过程中Li+向A电极迁移 | |
| C. | 阳极电极反应式为:2Cl--2e-═Cl2↑ | |
| D. | B极区电解液为LiOH溶液 |
分析 电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液,由图可知,右侧生成氢气,则B中氢离子放电,可知B为阴极,在B中制备LiOH,Li+由A经过阳离子交换膜向B移动;A中为LiCl溶液,氯离子放电生成氯气,据此回答.
解答 解:A、电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液,由图可知,右侧生成氢气,则B中氢离子放电,可知B为阴极,A为阳极,故A正确;
B、电解过程中Li+向阴极即向B电极迁移,故B错误;
C、电解池的阳极上是氯离子失电子,电极反应式为:2Cl--2e-═Cl2↑,故C正确;
D、电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液,由图可知,右侧生成氢气,则B中氢离子放电,可知B为阴极,在B中制备LiOH,B极区电解液为LiOH溶液,故D正确;
故选B.
点评 本题是一道高考题的改编题,侧重电解原理的应用知识,注意知识的迁移和应用是解题的关键,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 分子式为H2O和D2O的性质相同 | |
| B. | 相同条件下,等质量的碳按a、b两种途径完全转化,途径a和途径b放出的热能相等 途径a:C$→_{高温}^{H_{2}O}$CO+H2$→_{燃烧}^{O_{2}}$CO2+H2O,途径b:C$→_{燃烧}^{O_{2}}$CO2 | |
| C. | PM 2.5是指大气中直径接近2.5×10-6m的颗粒物,分散在空气中形成胶体 | |
| D. | 氢氧燃料电池的能量转换形式仅为化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22 g 2H218O中含有的质子数为10NA | |
| B. | 电解58.5 g熔融的NaCl,能产生11.2 L氯气(标准状况)、23.0 g金属钠 | |
| C. | 1.00 mol NaCl中,所有Na+的最外层电子总数为10NA | |
| D. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C被还原 | B. | C发生氧化反应 | C. | ZnCO3被氧化 | D. | ZnCO3是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直径介于1~100 nm之间的粒子称为胶体 | |
| B. | 电泳现象可证明胶体带电 | |
| C. | 1 mol•L-1的硫酸钠溶液和1 mol•L-1的氢氧化钠溶液,分别做导电性实验,两种溶液的导电性不同 | |
| D. | 氢氧化铁胶体能导电,故氢氧化铁胶体是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
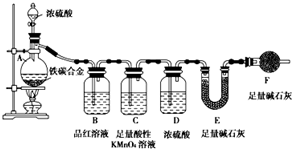 现有铁、碳两种元素组成的合金,某实验小组为了研究该合金的性质并测定该合金中碳的质量分数,设计了如下实验方案和实验装置
现有铁、碳两种元素组成的合金,某实验小组为了研究该合金的性质并测定该合金中碳的质量分数,设计了如下实验方案和实验装置查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入试剂按①SO42- ②Cl- ③OH-的正确顺序可以将混合液中Cu2+、Ba2+、Ag+逐一沉淀出来加以分离 | |
| B. | 配制480mL 1.0mol•L-1的NaOH溶液时,用托盘天平称取19.2gNaOH固体 | |
| C. | 用萃取分液的方法除去酒精中的水 | |
| D. | 用可见光束照射以区别溶液和胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com