
下列叙述正确的是
A.汽油、柴油和植物油都属于烃
B.乙烯和苯加入溴水中,都能观察到褪色现象,原因是都发生了加成反应
C.乙醇既能被氧化为乙醛也能被氧化为乙酸
D.淀粉和纤维素互为同分异构体
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015上海市高一上学期期末考试化学试卷(解析版) 题型:填空题
在25℃、100kPa条件下,将15L O2通入10L CO和H2的混合气中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
(1)若剩余气体的体积是15L,则原CO和H2的混合气中:V(CO)= ___________L;V(H2)= ___________L。
(2)若剩余气体的体积为a L,求原混合气体中CO和H2的体积比。
(3)若剩余气体的体积为b L,计算b的取值范围。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市丰台区高三一模理综化学试卷(解析版) 题型:实验题
(14分)铁及其化合物在日常生活中有广泛应用。
(1)写出Fe(OH)2转化为Fe(OH)3的化学方程式 。
(2)绿矾(FeSO4·7H2O)是补血剂的原料,易变质。检验绿矾是否变质的试剂是
设计实验检验绿矾是否完全变质
(3)利用绿矾制备还原铁粉的工业流程如下:
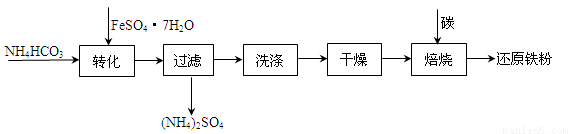
①干燥过程主要是为了脱去游离水和结晶水,过程中会有少量FeCO3·nH2O在空气中被氧化为FeOOH,该反应的化学方程式为
②取干燥后的FeCO3样品12.49g ,焙烧,最终得到还原铁粉6.16g,计算样品中杂质FeOOH的质量
(4)以羰基化合物为载体运用化学平衡移动原理分离、提纯某纳米级活性铁粉(含有一些不反应的杂质),反应装置如下图。
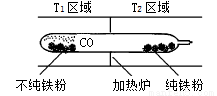
Fe(s)+5CO(g) 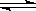 Fe(CO)5(g) ΔH<0
Fe(CO)5(g) ΔH<0
T1 T2(填“>”、“<”或“=”),判断理由是
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三第二次模拟理综化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.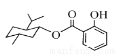 的分子式为C17H24O3
的分子式为C17H24O3
B.结构为…—CH=CH—CH=CH—CH=CH—CH=CH—…的高分子化合物,其单体是乙炔
C.有机硅聚醚(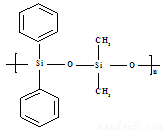 )可由单体
)可由单体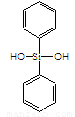 和
和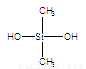 缩聚而成
缩聚而成
D.等质量的甲醇、甲醛、甲醚完全燃烧时的耗氧量依次递增
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省西安市高三下学期第一次月考理综化学试卷(解析版) 题型:实验题
(15分)苯甲酸乙酯(C9H10O2)别名为安息香酸乙酯。 它是一种无色透明液体,不溶于水,稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体,溶剂等。其制备方法为:

已知:
名称 | 相对分子质量 | 颜色,状态 | 沸点(℃) | 密度(g·cm-3) |
苯甲酸* | 122 | 无色片状晶体 | 249 | 1.2659 |
苯甲酸乙酯 | 150 | 无色澄清液体 | 212.6 | 1.05 |
乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |
*苯甲酸在100℃会迅速升华。
实验步骤如下:
①在圆底烧瓶中加入12.20 g苯甲酸,25 mL 95%的乙醇(过量),20 mL环己烷以及4 mL浓硫酸,混合均匀并加入沸石,按下图所示装好仪器,控制温度在65~70℃加热回流2 h。利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。
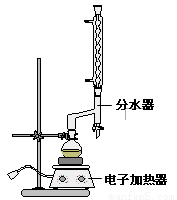
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞,继续加热,至分水器中收集到的液体不再明显增加,停止加热。
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液至呈中性。用分液漏斗分出有机层,水层用25 mL乙醚萃取分液,然后合并至有机层,加入氯化钙,静置,过滤,对滤液进行蒸馏,低温蒸出乙醚和环己烷后,继续升温,接收210~213℃的馏分。
④检验合格,测得产品体积为12.86 mL。
回答下列问题:
(1)在该实验中,圆底烧瓶的容积最适合的是 (填入正确选项前的字母)。
A.25 mL B.50 mL C.100 mL D.250 mL
(2)步骤①中使用分水器不断分离除去水的目的是 。
(3)步骤②中应控制馏分的温度在 。
A.65~70℃ B.78~80℃ C.85~90℃ D.215~220℃
(4)步骤③加入Na2CO3的作用是 ;若Na2CO3加入不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是 。
(5)关于步骤③中的萃取分液操作叙述正确的是 。
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,分液漏斗倒转过来用力振摇
B.振摇几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,应打开上口玻璃塞或将玻璃塞上的凹槽对准漏斗口上的小孔
(6)计算本实验的产率为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三下学期初考试理综化学试卷(解析版) 题型:填空题
氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5 kJ,则该反应的热化学方程式为 。
(2)298 K时,在2 L固定体积的密闭容器中,发生可逆反应:
2NO2(g) N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
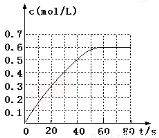
① 298k时,该反应的平衡常数为 L·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是 :
A.混合气体的密度保持不变;
B.混合气体的颜色不再变化;
C.气压恒定时。
③若反应在398K进行,某时刻测得n(NO2)=0.6 mol,n(N2O4)=1.2 mol,则此时V(正) V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。
现向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,
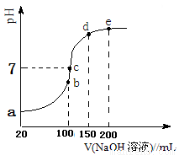
①b点时,溶液中发生水解反应的离子是______;
②在c点,溶液中各离子浓度由大到小的排列顺序 。
③d、e点对应溶液中,水电离程度大小关系是d e(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三下学期初考试理综化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.将过量的CO2通入Ca(ClO)2溶液中:H2O+CO2+Ca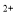 +2ClO
+2ClO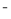 =CaCO3↓+2HClO
=CaCO3↓+2HClO
B.将少量NaOH溶液加入到NH4HCO3溶液中:OH-+HCO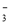 =CO
=CO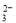 +H2O
+H2O
C.Fe3O4与稀HNO3反应:Fe3O4+8H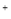 =Fe
=Fe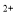 +2Fe
+2Fe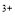 +4H2O
+4H2O
D.向NaHCO3溶液中加入少量Ca(OH)2:HCO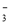 +Ca
+Ca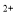 +OH
+OH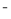 =CaCO3↓+H2O
=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省莆田市高三质量检测化学试卷(解析版) 题型:填空题
(11分)天然气是一种重要的化工原料。
I.2014年5月,我国科学家成功实现了甲烷在无氧条件下选择活化,一步高效生产乙烯、苯、氢气等高值化学品。
(1)苯的二氯代物的同分异构体有 种。
(2)乙烯通入溴的四氯化碳溶液中,反应的化学方程式为 。
(3)已知甲烷、乙烯、氢气燃烧的热化学方程式分别如下:
①CH4(g) +2O2(g) === CO2(g) +2H2O ( l ) ΔH= - 890.3 kJ·mol-1
②C2H4(g)+3O2(g) === 2CO2(g) +2H2O ( l ) ΔH= - 1 306.4 kJ·mol-1
③2H2 (g)+O2 (g) === 2H2O ( l ) ΔH= - 571.6 kJ·mol-1
则2CH4(g) ===C2H4(g) +2H2 (g) 的 ΔH = 。
Ⅱ.甲烷的传统转化利用,第一步制取合成气(CO、H2),第二步用合成气制取甲醇(CH3OH)、二甲醚(CH3OCH3)等。
(4)某温度下,将1mol CH4和1 mol H2O(g)充入容积为0.5 L的密闭容器中,发生如下反应:
CH4(g) +H2O(g)  CO(g) +3H2 (g) ΔH= +206.4 kJ·mol-1
CO(g) +3H2 (g) ΔH= +206.4 kJ·mol-1
当反应达到平衡时,测得其平衡常数K=27。
①CH4的平衡转化率 = 。
②如果其它条件不变,升高温度,CH4的平衡常数 (填“增大”、“减小”或“不变”)。
(5)在一定条件下,合成气发生如下两个主要反应:
CO(g)+2H2(g)=== CH3OH(g) ΔH= -90.1kJ·mol-1
2CO(g)+4H2(g)=== CH3OCH3(g) + H2O(g) ΔH= -204.7kJ·mol-1。
仅根据下图,选择该条件下制取甲醇的最佳温度为 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com