
分析 该原电池中,锌电极上电极反应式为Zn-2e-=Zn2+,铜电极上电极反应式为2H++2e-=H2↑,则电池反应式为Zn+2H+=H2↑+Zn2+,
(1)根据氢气和锌之间的关系式计算锌的质量;
(2)根据氢气和转移电子之间的关系式计算转移电子的物质的量;
(3)根据氢原子守恒计算硫酸的浓度.
解答 解:该原电池中,锌电极上电极反应式为Zn-2e-=Zn2+,铜电极上电极反应式为2H++2e-=H2↑,则电池反应式为Zn+2H+=H2↑+Zn2+,
(1)设参加反应的Zn的质量为x,
Zn+2H+=H2↑+Zn2+
65g 22.4L
x 3.36L
则x=$\frac{65g×3.36L}{22.4L}$=9.75g
答:消耗锌的质量9.75g;
(2)设转移电子的物质的量为y,
Zn+2H+=H2↑+Zn2+转移电子
22.4L 2mol
3.36L y
y=$\frac{3.36L×2mol}{22.4L}$=0.30mol,
答:通过电子的物质的量为0.30mol;
(3)根据氢原子守恒得H2SO4~H2,则c(H2SO4)=$\frac{\frac{3.36L}{22.4L/mol}}{0.2L}$=0.75 mol•L-1,
答:原硫酸的浓度为0.75 mol•L-1.
点评 本题以原电池原理为载体考查了物质的量的有关计算,根据各个物理量之间的关系来分析解答,题目难度中等.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
| 正极 | 负极 | 电解质溶液 | |
| A | Cu | Zn | HCl |
| B | Zn | Cu | CuSO4 |
| C | Cu | Zn | CuSO4 |
| D | Cu | Zn | ZnCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

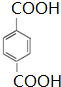 .
. +2Br2$\stackrel{光照}{→}$
+2Br2$\stackrel{光照}{→}$ +2HBr.?
+2HBr.? $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$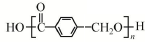 +(n-1)H2O.
+(n-1)H2O.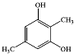 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用BaCl2 溶液可证明Na2CO3溶液显碱性时由于CO32-发生水解 | |
| B. | NaHCO3 溶液中存在:c(Na+ )=c(HCO3-)+c(CO3 2-) | |
| C. | CH3COOH溶液中加入少量CH3COONa 固体后溶液中c(H+)•c(CH3COO-)增大 | |
| D. | 相同温度下,Ksp较小的物质其溶解度也一定较小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com