
| A. | 氯化钠和铁的熔化 | B. | 二氧化硅和生石灰的熔化 | ||
| C. | 碘和干冰的升华 | D. | 食盐和冰的熔化 |
分析 分子晶体熔融时破坏分子间作用力,离子晶体熔融时破坏离子键,原子晶体熔融时破坏共价键,金属晶体熔融时破坏金属键,物质气化或熔化时,所克服的微粒间的作用力,属同种类型说明晶体类型相同,据此分析解答.
解答 解:A.氯化钠是离子晶体,熔融时破坏离子键,铁是金属晶体,熔融时破坏金属键,所以克服作用力不同,故A错误;
B.二氧化硅是原子晶体,熔融时破坏共价键,生石灰是离子晶体,熔融时破坏离子键,所以克服作用力不同,故B错误;
C.碘和干冰都是分子晶体,升华时都破坏分子间作用力,克服作用力相同,故C正确;
D.食盐是离子晶体,熔融时破坏离子键,冰是分子晶体,熔融时破坏分子间作用力,所以克服作用力不同,故D错误;
故选C.
点评 本题考查晶体微粒间作用力,侧重考查晶体类型判断,明确常见晶体所属类型是解本题关键,注意原子晶体熔融要破坏共价键,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| X | Y | ||
| W | Z | ||
| T |
| A. | X、Y、Z最低价氢化物的沸点依次升高 | |
| B. | X、Y和氢形成的化合物中只有共价键 | |
| C. | WY2、W3X4、WZ4均为原子晶体 | |
| D. | 元素T的单质可作半导体材料,T与Z元素可形成化合物TZ4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如果电子云图象是由两个s电子重叠形成的,即形成s-sσ键 | |
| B. | s电子与p电子形成s-pσ键 | |
| C. | p电子和p电子不能形成σ键 | |
| D. | HCl分子里含有一个s-pσ键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
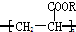 ,下列有关它的说法中,不正确的是( )
,下列有关它的说法中,不正确的是( )| A. | 它可由CH2=CH-COOR经加成聚合反应得到 | |
| B. | 在一定条件下能发生加成反应 | |
| C. | 聚丙烯酸酯材料是一种混合物 | |
| D. | 聚丙烯酸酯是高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO的结构式:H-O-Cl | B. | H2O2的电子式 | ||
| C. | CO2的比例模型 | D. | ${\;}_{8}^{18}{O}^{2-}$离子结构示意图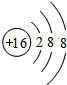 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有② | B. | 只有②④ | C. | 只有②③④ | D. | 只有①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
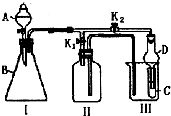 某兴趣小组设计了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质.
某兴趣小组设计了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com