
 .
.分析 (1)A:Na2O2与H2O反应,从而无法得到Na2FeO4;
B:反应中NaClO、Na2O2均获得电子,为氧化剂.Na2FeO4为氧化产物;
C:FeSO4既有氧化性,也有还原性;
D:FeSO4不能与KSCN溶液反应生红色溶液.
(2)A:根据反应:Fe2O3+3Na2O2═2Na2FeO4+Na2O,Na2O2在反应中只获得电子,只作氧化剂;
B:Na2O2对应的产物包含Na2FeO4、Na2O,二者都是还原产物;
C:3 mol Na2O2发生反应,有6 mol电子转移;
D:Na2FeO4中Fe元素的化合价为+6价.
故选C.
(3)①反应前后Fe元素的化合价有+3→+6失去3个电子,化合价升3,而 Cl元素则有0→-1价,得到1个电子,化合价降1,由于本反应的氧化剂为Cl2,然后依据得失电子守恒结合原子个数守恒写出反应的方程式;结合氧化还原反应的有关概念分析;
②根据化学方程式,通过物质间的比例关系,可用高铁酸钠的质量计算所消耗的氧化剂的物质的量.
(4)根据电解方程式:Fe+2NaOH+2H2O=Na2FeO4+3H2↑,可知在碱性条件下,消耗NaOH;Fe失电子生成FeO42-.
解答 解:(1)A:方法b、c中都有Na2O2参与反应,若在水溶液中进行,Na2O2与H2O反应,从而无法得到Na2FeO4,故A选项错误;
B:反应中NaClO、Na2O2均获得电子,为氧化剂.Na2FeO4为氧化产物,所以NaClO、Na2O2的氧化性均强于Na2FeO4的氧化性,故B选项正确;
C:FeSO4中的Fe元素为+2价,在反应中可失去电子,也可得到电子,所以FeSO4既有氧化性,也有还原性,故C选项错误;
D:FeSO4不能与KSCN溶液反应生红色溶液,故D选项错误.
故选B.
(2)A:根据反应:Fe2O3+3Na2O2═2Na2FeO4+Na2O,Na2O2在反应中只获得电子,只作氧化剂,故A选项错误;
B:Na2O2对应的产物包含Na2FeO4、Na2O,二者都是还原产物,故A选项错误;
C:3 mol Na2O2发生反应,有6 mol电子转移,故C选项正确;
D:Na2FeO4中Fe元素的化合价为+6价,故D选项错误.
故选C.
(3)①反应中,铁元素化合价升高,失电子,Cl元素化合价降低,得到电子,化合价降低值=化合价升高值=转移电子数=6,电子转移情况如下: ,
,
故答案为: .
.
②设消耗的氧化剂的物质的量为x.
2Fe(NO3)3+16NaOH+3Cl2═2Na2FeO4+6NaCl+6NaNO3+8H2O
3 332
x 8.3g
x=0.075mol.
故答案为:0.075mol.
(4)消耗NaOH,电解后溶液的PH与原电解液相比减小,其阳极的电极方程式为:Fe-6e+8OH-=FeO42-+4H2O,
故答案为:减小;Fe-6e+8OH-=FeO42-+4H2O,
点评 本题考查氧化还原反应知识,侧重于学生的分析能力的考查,题目难度中等,注意从元素化合价的角度判断氧化还原反应的相关概念,注意能熟练用单线桥法标出电子转移的方向和数目.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 硫酸工业中,增大O2的浓度有利于提高SO2的转化率 | |
| B. | 开启啤酒瓶后,瓶中立刻泛起大量泡 | |
| C. | 对2HI(g)?H2(g)+I2(g)平衡体系增加压强使颜色变深 | |
| D. | 滴有酚酞的氨水溶液,适当加热溶液(氨气不挥发)后颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
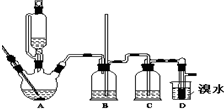 实验室制备1,2二溴乙烷的反应原理如下:
实验室制备1,2二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
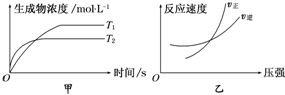
| A. | a+b>c+d T1>T2△H>0 | B. | a+b>c+d T1<T2 △H<0 | ||
| C. | a+b<c+d T1>T2△H>0 | D. | a+b>c+d T1>T2△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com