

| A. | Cu电极上发生氧化反应 | B. | 电子沿Zn→a→b→Cu路径流动 | ||
| C. | 片刻后甲池中c(K+)增大 | D. | 片刻后可观察到滤纸a点变红色 |
分析 甲、乙装置能自发的进行氧化还原反应,所以是原电池,锌易失电子作负极,铜作正极,则含有硫酸钾溶液的滤纸是电解池,a是阴极,b是阳极,阴极上氢离子放电,阳极上氢氧根离子放电,电子从负极沿导线流向电解池阴极,原电池放电时,阴离子向负极移动,阳离子向正极移动,以此解答该题.
解答 解:A.Zn较活泼,作原电池的负极,Cu作原电池的正极,Cu电极是发生还原反应,故A错误;
B.电子流向是负极到正极,但a→b这一环节是在溶液中导电,是离子导电,电子并没沿此路径流动,故B错误;
C.锌为负极,原电池工作时阳离子向正极移动,则乙池c(K+)增大,故C错误;
D.电解池中,a电极上氢离子放电生成氢气,同时a电极附近生成氢氧根离子,导致溶液碱性增强,所以a极变红色,故D正确.
故选D.
点评 本题考查了原电池和电解池原理,明确各个电极上发生的电极反应是解本题关键,易错选项是B,注意电子不进入电解质溶液,电解质溶液是通过阴阳离子的定向移动形成电流,为易错点.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | |||||||
| B | C | D | |||||
| E | F | G | |||||
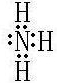 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:r(Y)>r(Z)>r(W) | |
| B. | 元素Z、W的简单离子的电子层结构不同 | |
| C. | 元素Y的简单气态氢化物的热稳定性比Z的强 | |
| D. | 只含X、Y、Z三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Al3+、CO32-、Cl- | B. | Na+、H+、SO42-、SiO32- | ||
| C. | H+、NH4+、SO42-、I- | D. | H+、Fe2+、Cl-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业电解饱和食盐水:2Cl-+H2O=Cl2↑+H2↑+OH- | |
| B. | 碳酸钠的水解:CO32-+2H2O═H2CO3+2OH- | |
| C. | 硫酸铝溶液中滴加过量浓氨水:Al3++4 NH3•H2O═AlO${\;}_{2}^{-}$+4NH4++2H2O | |
| D. | 用过氧化氢从酸化海带灰浸出液中提取碘:2I-+H2O2+2H+=I2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编组 | 强电解质 | 弱电解质 | 非电解质 |
| A | NaCl | HF | Cl2 |
| B | Ba(OH)2 | H2S | C2H5OH |
| C | H2SO4 | CaCO3 | CCl4 |
| D | AgCl | HClO | Cu |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com