
【题目】某同学设计了甲烷燃料电池并探究某些工业电解原理(如图所示),其中乙装置为探究氯碱工业原理(X为阳离子交换膜,C为石墨电极),丙装置为探究粗铜精炼原理。请回答下列问题:

(1)从 b口通入的气体发生的电极反应为______________________________。
(2)写出乙中发生的总反应的离子方程式为________________________________。
(3)当b口消耗标况下2.24L的气体时,则A极增重质量为__________________
【答案】CH4+10OH--8e-=CO32-+7H2O 2Cl-+2H2O Cl2↑+H2↑+2OH- 12.8g
Cl2↑+H2↑+2OH- 12.8g
【解析】
(1)乙装置为探究氯碱工业原理(X为阳离子交换膜,C为石墨电极),则Fe作阴极、碳作阳极,所以通入a的电极材料是正极、通入b的电极为负极;
(2)乙中阳极上氯离子放电生成氯气,阴极上水得电子生成氢气和氢氧根离子;
(3)根据串联电池中转移电子数相等计算丙装置中析出铜的质量。
(1)根据分析可知通入b的电极为负极,甲烷燃料电池中负极通入甲烷,所以电极方程式为:CH4+10OH--8e-=CO32-+7H2O.故答案为:CH4+10OH--8e-=CO32-+7H2O;
(2)乙中阳极上氯离子放电生成氯气,阴极上水得电子生成氢气和氢氧根离子,则电池反应式为2Cl-+2H2O Cl2↑+H2↑+2OH-,故答案为:2Cl-+2H2O
Cl2↑+H2↑+2OH-,故答案为:2Cl-+2H2O Cl2↑+H2↑+2OH-;
Cl2↑+H2↑+2OH-;
(3)串联电池中转移电子数相等,若在标准状况下,有2.24L氧气参加反应,则转移电子的物质的量=![]() =0.4mol,A极发生反应2Cu 2++2e-=Cu,转移0.4mol电子时生成Cu的物质的量为0.2mol,质量为0.2mol×64g/mol=12.8g,故答案为:12.8g。
=0.4mol,A极发生反应2Cu 2++2e-=Cu,转移0.4mol电子时生成Cu的物质的量为0.2mol,质量为0.2mol×64g/mol=12.8g,故答案为:12.8g。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
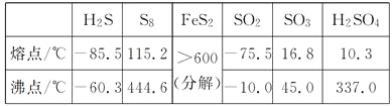
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为____________________________,基态S原子电子占据最高能级的电子云轮廓图为________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是__。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________________。
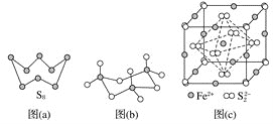
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为________形,其中共价键的类型有________种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为anm、FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为______________________________g·cm-3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为________nm。
所形成的正八面体的体心,该正八面体的边长为________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁过程中发生反应:![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g) ![]()
![]() Fe(s)+CO2(g),该反应在不同温度下的平衡常数见表。
Fe(s)+CO2(g),该反应在不同温度下的平衡常数见表。
温度T/℃ | 1000 | 1150 | 1300 |
平衡常数K | 4.0 | 3.7 | 3.5 |
下列说法正确的是
A. 增加高炉的高度可以有效降低炼铁尾气中CO的含量
B. 由表中数据可判断该反应:反应物的总能量>生成物的总能量
C. 为了使该反应的K增大,可以在其他条件不变时,增大c(CO)
D. 1000℃下Fe2O3与CO反应,t min达到平衡时c(CO) =2×10-3 mol/L,则用CO表示该反应的平均速率为![]() mol/(L·min)
mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气与生态圈的氮循环如图所示,下列叙述不正确的是

A. ④维持大气中氮元素含量稳定
B. ①是野生植物生长所需氮元素的重要来源
C. ⑤为硝化过程、④为反硝化过程,都是氮元素的还原反应过程
D. ②是氮肥工业基础,科学家努力将固氮变化条件趋近生物固氮
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程都与热量变化有关,其中表述不正确的是 ( )
A.稀盐酸和稀氢氧化钠溶液反应的中和热为57.3 kJ/mol,则表示稀硫酸与稀氢氧化钡溶液发生反应的热化学方程式为:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol
B.CO(g)的燃烧热是283.0 kJ/mol,则表示CO(g)燃烧反应的热化学方程式为:CO(g)+1/2 O2(g)=CO2(g) ΔH=-283.0 kJ/mol
C.铝热反应是放热反应,但需要足够的热量才能使反应发生
D.醋酸的电离过程是吸热过程,升高温度,醋酸的Ka增大、pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,将a mol O2与bmol SO2的混合气体通入一个固定容积的密闭容器中,发生如下反应:O2(g) + 2SO2(g)![]() 2SO3(g)
2SO3(g)
(一)①若反应达平衡时,n(O2) = 4mol,n(SO3) = 4mol,计算a的值为____。
②平衡时总体积在标准状况为313.6L,原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始)∶n(平) =____。
③达到平衡时,O2和SO2的转化率之比,α(O2)∶α (SO2)=____。
(二)若起始将6mol O2、b mol SO2和1 molSO3通入上反应容器中,起始反应向正方向进行,使反应达到平衡时容器中气体的物质的量为12mol。则b的取值范围是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡状态的是( )
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡状态的是( )
A. 2v(NH3)=v(CO2) B. 密闭容器中c(NH3)∶c(CO2)=2∶1
C. 密闭容器中混合气体的密度不变 D. 密闭容器中氨气的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA是阿伏加德罗常数的值。下列说法正确的是( )
A.1mol![]() 中共平面的碳原子数最多为6NA
中共平面的碳原子数最多为6NA
B.1L0.5mol/LKHC2O4溶液中含HC2O4-和H2C2O4的数目为0.5NA
C.25℃、1.01×105 Pa下,44.8LSO2和CO2的混合气体中所含分子数为2NA
D.12.0gNaHSO4和MgSO4的固体混合物中所含阳离子总数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于A2(g)+3B2(g)![]() 2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
A. v(A2)=0.8 mol·L-1·s-1 B. v(A2)=30 mol·L-1·min-1
C. v(AB3)=1.0 mol·L-1·s-1 D. v(B2)=1.2 mol·L-1·s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com