
【化学——选修3:物质结构与性质】(15分)
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于元素周期表的_________区;溴的价电子排布式为____________________。
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________。
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是_________。
| 氟 | 氯 | 溴 | 碘 |
第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图I、II所示:
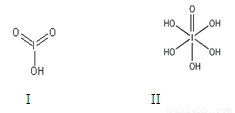
请比较二者酸性强弱:HIO3_____ H5IO6(填“>”、 “<”或“=”)。
(5)已知ClO2- 为角型,中心氯原子周围有四对价层电子。ClO2- 中心氯原子的杂化轨道类型为___________,写出一个ClO2- 的等电子体__________。
(6)下图为碘晶体晶胞结构。有关说法中正确的是_____________。
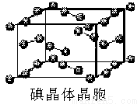
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
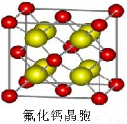
(7)已知CaF2晶体(见图)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。
(1)P (1分)4S24P5(1分) (2) 氢键(1分)
(3)碘(2分) (4)>(2分)
(5)sp3 (2分) Cl2O (或OF2等合理答案) (2分)
(6)AD(2分)
(7)a3ρNA/4(2分)
【解析】
试题分析:⑴卤族元素位于周期表第17列(P区),溴(主族元素)原子的价电子排布为4S24P5;
⑵氢氟酸分子间通过氢键缔合成(HF)2。
⑶由于碘的第一电离能在卤素原子中相对较小,最有可能生成较稳定的单核阳离子。
⑷HIO3的非羟基氧原子数(2)多,酸性较H5IO6 [非羟基氧原子数为1]强。
⑸由于ClO2- 的中心氯原子周围有四对价层电子,其中心氯原子的杂化轨道类型为sp3;根据“增减找邻、同族互换”的原则可确定ClO2- 的等电子体为Cl2O或OF2。
⑹碘晶体晶胞结构属于面心立方晶胞,每个晶胞中含有8×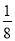 +6×
+6×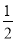 =4个碘分子,但碘原子数为8,B项错误;碘晶体属于分子晶体,C项错误。
=4个碘分子,但碘原子数为8,B项错误;碘晶体属于分子晶体,C项错误。
⑺在CaF2晶胞中含有Ca2+:8×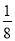 +6×
+6×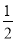 =4个,含有F-:8个,相当于有4个CaF2,则ρ=
=4个,含有F-:8个,相当于有4个CaF2,则ρ= ,化简得M=)a3ρNA/4。
,化简得M=)a3ρNA/4。
考点:本题考查物质结构与性质(元素的分区、价电子排布式、氢键、第一电离能、含氧酸的酸性大小、晶胞的相关计算与判断)。


科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:填空题
(6分) 在一定温度下,将4mol SO2与2molO2放入4L的密闭容器中,在一定条件下反应,10分钟时达到平衡: 2SO2 + O2  2SO3 测得平衡时混合物总物质的量为5mol,求:
2SO3 测得平衡时混合物总物质的量为5mol,求:
(1)10分钟时O2的反应速率为 mol/(L·min)(2)平衡时SO2的转化率
(3) 平衡常数K为多少
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
A.标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为7/22.4NA
B. 1mol甲基(-CH3)所含的电子总数为9NA
C. 0.5mol 1, 3-丁二烯分子中含有碳碳双键数为NA
D. 1 mol氯气溶于水发生反应转移电子的物质的量小于1mol
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
根据表中的信息判断下列说法正确的是( )。
物质 | 金刚石 | 石墨 |
外观 | 无色,透明固体 | 灰黑,不透明固体 |
熔点 | ? | ? |
燃烧热/(kJ·mol-1) | 395.4 | 393.5 |
A.表示石墨燃烧热的热化学方程式为C(石墨,s)+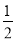 O2(g)=CO(g) ΔH=-393.5kJ·mol-1
O2(g)=CO(g) ΔH=-393.5kJ·mol-1
B.由表中信息知C(石墨,s)=C(金刚石,s) ΔH=+1.9kJ·mol-1
C.由表中信息可得如图所示的图像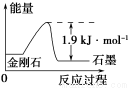
D.由表中信息可推知相同条件下金刚石的熔点高于石墨的熔点
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
下列有关叙述正确的是( )
A. O和
O和 O中子数相同,质子数不同,互为同位素
O中子数相同,质子数不同,互为同位素
B.H2O比H2S稳定,H—S键比H—O键更难断裂
C.Na2O晶体中存在离子键,是离子化合物
D.Na2O2晶体中阳离子与阴离子个数比为1:1
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高三终极预测理综化学试卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是
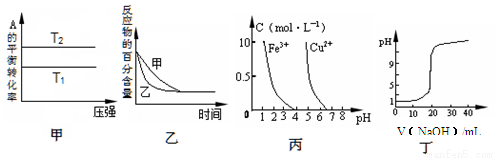
A.由图甲可以判断:对于反应aA(g)+ bB(g) cC(g),若T1>T2, 则a +b=c且 ?H<0
cC(g),若T1>T2, 则a +b=c且 ?H<0
B.图乙表示压强对可逆反应2A(g)+2 B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.根据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH溶液,调节pH≈4
D.图丁表示用0.1000 mol/L NaOH溶液滴定20.00 mL0.1000 mol/L醋酸溶液得到的滴定曲线
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高三第三次模拟考试理综化学试卷(解析版) 题型:推断题
[化学——选修5:有机化学基础](15分)
某有机物A的水溶液显酸性,遇FeCl3溶液不显色,A分子结构中不含甲基,含苯环,苯环上的一氯代物只有两种, A和其他有机物存在如下图所示的转化关系:
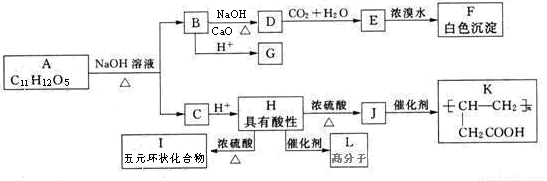
已知: 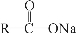 + NaOH
+ NaOH 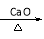 R—H + Na2CO3
R—H + Na2CO3
试回答下列问题:
(1)B化学式 ,G的化学名称是 。
(2)H→I反应类型为 ,J所含官能团的名称为 。
(3)写出H→L 反应的化学方程式 。
(4)A的结构简式 。
(5)F的同分异构体中含有苯环且官能团相同的物质共有 种(不包括F),其中核磁共振氢谱有两个峰,且峰面积比为1︰2的是 (写结构简式)。
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:实验题
(10分)某研究性学习小组的同学利用下列装置进行乙醇催化氧化的实验。请分析回答:
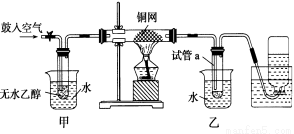
(1)请写出实验过程中的总的化学反应方程式______________________________。
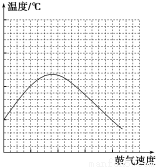
(2)在不断鼓入空气的情况下,移去酒精灯,反应仍能继续进行,说明乙醇的催化氧化反应是________反应。进一步研究表明,鼓气速度与反应体系的温度关系曲线如右图所示。鼓气速度过快,反应体系温度反而下降的原因___________________________。
(3)甲和乙两个水浴作用不相同。
甲的作用是________________;乙的作用是_________________________。
(4)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是___________。集气瓶中收集到的气体的主要成分是_______________。
(5)在检验生成物的过程中,一位同学很偶然地发现向溴水中加入乙醛溶液,溴水褪色。针对溴水褪色的原因,该小组的同学们经过分析后,提出两种猜想:
①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应。
请你设计一个简单的实验,探究哪一种猜想正确?__________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的值。下列叙述中不正确的是( )
A.1mol乙烯与乙醇的混合物在氧气中充分燃烧,消耗氧气的分子数为一定为3NA
B.28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA
C.常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
D.常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com