
| A. | 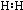 | B. |  | C. | 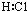 | D. | 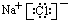 |
分析 A.氢气中两个氢原子共用1对电子;
B.氮气中两个氮原子共用3对电子达到8电子稳定结构;
C.氯化氢中氢原子与氯原子共用1对电子,氯原子达到8电子稳定结构;
D.氯化钠为离子化合物,钠离子与氯离子通过离子键结合.
解答 解:A.氢气中两个氢原子共用1对电子,电子式为:H:H,故A正确;
B.氮气分子中两个N原子形成三对共用电子对,氮气分子的电子式为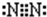 ,故B正确;
,故B正确;
C.氯化氢属于共价化合物,分子中存在一个H-Cl键,氯原子最外层达到8个电子,氯化氢正确的电子式为 ,故C错误;
,故C错误;
D.NaCl为离子化合物,由钠离子与氯离子构成,电子式为: ,故D正确;
,故D正确;
故选:C.
点评 本题考查了电子式的判断,主要是考查学生对常见化学用语的熟悉掌握程度,注意掌握电子式的概念及正确的表示方法是解题关键,题目难度不大.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2+HCl $→_{△}^{催化剂}$ CH3CH2Cl | |
| B. | CH4+Cl2 $\stackrel{光}{→}$CH3Cl+HCl | |
| C. | nCH2=CH2$→_{加热、加压}^{催化剂}$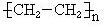 | |
| D. | CH3CH2Br+NaOH$→_{△}^{乙醇}$CH2=CH2↑+NaBr+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大理石溶于醋酸的反应:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O | |
| B. | 实验室制取CO2:CO32-+2H+═CO2↑+H2O | |
| C. | 铁和硝酸银溶液反应:Fe+Ag+═Ag+Fe2+ | |
| D. | Ca(HCO3)2溶液中加入过量KOH溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
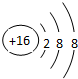
| A. | Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点 | |
| B. | 原子半径:Z>Y>X | |
| C. | CaY2与水发生氧化还原反应时,CaY2只作氧化剂 | |
| D. | CaY2和CaZ22种化合物中,阳离子与阴离子个数比均为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
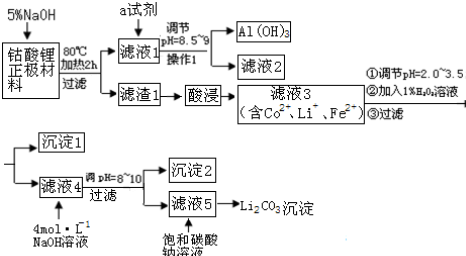
| 金属氢氧化物 | 金属离子浓度 1mol•L-1 | 金属离子浓度 0.1mol•L-1 | 沉淀完全时的pH值 | |
| 分子式 | Ksp | 开始沉淀时的pH | ||
| Fe(OH)2 | 4.87×10-17 | 5.8 | 6.3 | 8.3 |
| Fe(OH)3 | 2.79×10-39 | 1.2 | 1.5 | 2.8 |
| Co(OH)2 | 5.92×10-15 | 6.9 | 7.4 | 9.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com