
下列说法错误的是
A.增大反应物的浓度,可增大活化分子的百分数,从而使反应速率增大
B.决定化学反应速率的主要因素是参加反应的物质的性质
C.NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g)ΔH=+185.57kJ•mol?1,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
D.升温能使化学反应速率增大的主要原因是增大了反应物分子中活化分子的百分数
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:选择题
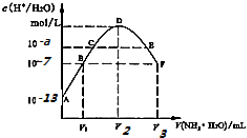
| A. | 稀硫酸的浓度为0.1mol/L | |
| B. | C点溶液pH=14-a | |
| C. | E溶液中存在:c(NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| D. | B到D、D到F所加氨水体积一定相等 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上10月月考化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.室温下,pH=11的氨水与pH=3的盐酸等体积混合:c(Cl﹣)=c(NH4+)>c(OH﹣)=c(H+)
B.醋酸与醋酸钠的pH=7的混合溶液中:c(CH3COO﹣)+c(CH3COOH)<c(Na+)
C.相同物质的量浓度的NaClO和NaHCO3混合溶液中:c(HClO)+c(ClO﹣)=c(HCO3﹣)+c(H2CO3)+c(CO32﹣)
D.c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c[(NH4)2SO4]>c(NH4Cl)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上10月月考化学试卷(解析版) 题型:选择题
下列关于物质分类的说法正确的是
①稀豆浆、硅酸、氯化铁溶液都属于胶体
②氯水、次氯酸都属于弱电解质
③Na2O、MgO、Al2O3均属于碱性氧化物
④明矾、冰水混合物、四氧化三铁都不是混合物
⑤电解熔融的Al2O3、12C转化为14C都属于化学变化
⑥葡萄糖、油脂都不属于有机高分子
A.①② B.②④ C.③⑤ D.④⑥
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
以Pt为电极,电解含有0.10molM+和0.10molN3+(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如右图。对离子氧化能力的强弱判断正确的是(选项中H+为氢离子)

A.M+>H+>N3+
B .M+>N3+>H+
.M+>N3+>H+
C.N3+>H+>M+
D.条件不足,无法确定
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
下列依据热化学方程式得出的结论正确的是
A.若2H2(g)+O2(g)=2H2O(g)ΔH=—483.6kJ·mol-1,则H2燃烧热为241.8kJ·mol-1
B.若C(石墨,s)=C(金刚石,s)ΔH>0,则石墨比金刚石稳定
C.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)ΔH=—57.4kJ·mol-1,则20.0gNaOH固体与稀盐酸完全中和 ,放出28
,放出28 .
. 7kJ的热量
7kJ的热量
D.已知2C(s)+2O2(g)=2CO2(g)ΔH1;2C(s)+O2(g)=2CO(g)ΔH2,则ΔH1>ΔH2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:实验题
50mL 1.Omol·L—1盐酸跟50mL 1.1mol·L—1氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
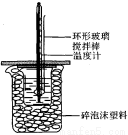
(1)大小烧杯间填满碎泡沫塑料的作用是_______________。
(2)_________(填“能”或“不能”)将环形玻璃搅拌棒改为环形金属(如铜)棒。其原因是__________________。
(3)大烧杯上如不盖硬纸板,对求得中和热数值的影响是________(填“偏高”“偏低”或“无影响”)。
(4)如果改用60mL 1.Omol·L—1盐酸跟50mL 1.1mol·L—1氢氧化钠溶液进行反应,则与上述实验相比,所放热量_______(填“增加” “减少”或“不变”),理由是_____________;所求中和热数值_________(填“增加”“减少”或“不变”),理由是_______________;
(5)________(填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是______________________.
(6)Q=cm△t,其中Q表示此中和反应放出的热量,m表示反应后混合液的质量,c表示反应后混合溶液的比热容,△t表示反应前后溶液的温度的差值。该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据。
实验序号 | 起始温度t1/℃ | 终止温度/t2/℃ | 温差(t2-t1)/ ℃ |
1 | 25.0 | 32.6 | |
2 | 25.1 | 31.8 | |
3 | 25.1 | 31.9 |
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容c=4.184×10—3kJ/(g·℃),则该反应的中和热为△H=____________(保留小数点后一位)。
(7)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是_______(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰 视读数
视读数
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升温 | B. | 加压 | C. | 增加D的量 | D. | 加入催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .(不考虑空间构型)
.(不考虑空间构型)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com