


 .(用结构简式表示)
.(用结构简式表示) 分析 由转化关系可知,E含有羧基、G含有-OH,且E、G含有相同的碳原子数目,故E与G发生酯化反应生成H,由H的分子式可知,E为CH3CH2COOH,F中含有2个甲基,则G为CH3CH(OH)CH3,逆推可得,F为CH3CHClCH3,D为CH3CH2CHO,C为CH3CH2CH2OH,B为CH3CH2CH2Cl,A为CH3CH=CH2,以此解答该题.
解答 解:由转化关系可知,E含有羧基、G含有-OH,且E、G含有相同的碳原子数目,故E与G发生酯化反应生成H,由H的分子式可知,E为CH3CH2COOH,F中含有2个甲基,则G为CH3CH(OH)CH3,逆推可得,F为CH3CHClCH3,D为CH3CH2CHO,C为CH3CH2CH2OH,B为CH3CH2CH2Cl,A为CH3CH=CH2,
(1)通过以上分析知,D结构简式为CH3CH2CHO,
故答案为:CH3CH2CHO;
(2)A在双氧水作催化剂条件下,和HCl发生加成反应生成B,反应方程式为CH3CH═CH2+HCl$\stackrel{H_{2}O_{2}}{→}$CH3CH2CH2Cl,
故答案为:CH3CH═CH2+HCl$\stackrel{H_{2}O_{2}}{→}$CH3CH2CH2Cl;
(3)G为CH3CH(OH)CH3,F为CH3CHClCH3,F和NaOH的水溶液共热发生取代反应或水解反应生成G,
故答案为:取代反应(或水解反应);
(4)E和G在浓硫酸作催化剂、加热条件下发生酯化反应生成酯H,反应方程式为CH3CH2COOH+CH3CH(OH)CH3$→_{△}^{浓硫酸}$CH3CH2COOCH(CH3)2+H2O,
故答案为:CH3CH2COOH+CH3CH(OH)CH3$→_{△}^{浓硫酸}$CH3CH2COOCH(CH3)2+H2O;
(5)H为CH3CH2COOCH(CH3)2,H有多种同分异构体,其中含有一个羧基,且其一氯代物有两种的是 ,
,
故答案为: .
.
点评 本题考查有机物推断,为高考常见题型,侧重考查学生分析推断及知识迁移能力,根据H分子式结合题给信息进行推断,注意:反应条件不同导致其产物不同,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2SO4 的质量为98 g•mol-1 | |
| B. | H2SO4的摩尔质量为98 g | |
| C. | 9.8 g H2SO4含有NA个H2SO4分子 | |
| D. | 6.02×1022个H2SO4分子的质量为9.8 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
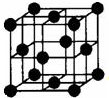 早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成.回答下列问题:
早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
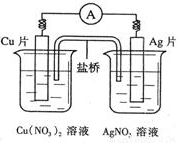
| A. | 在外电路中,电子由银电极流向铜电极 | |
| B. | 取出盐桥后,电流计的指针仍发生偏转 | |
| C. | 外电路中每通过0.1 mol电子,铜的质量理论上减小6.4 g | |
| D. | 原电池的总反应式为Cu+2AgNO3=2Ag+Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22 g 2H218O中含有的质子数为10NA | |
| B. | 标准状况下,2.24 L乙醇中含有的C-H键数目为0.5NA | |
| C. | 0.1 mol/L的NaF溶液中所含F-的数目小于0.1NA | |
| D. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去0.5NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨是一种重要的化工原料,也是重要的工业产品,在工农业生产和国防等领域发挥着重要作用.
氨是一种重要的化工原料,也是重要的工业产品,在工农业生产和国防等领域发挥着重要作用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.1mol•L-1氨水中加入少量水,溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$减少 | |
| B. | 将NH4Cl溶液从20℃升温至30℃,溶液中$\frac{c(N{H}_{4})}{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}$增大 | |
| C. | 向氢氧化钠溶液中加入醋酸至中性,溶液中$\frac{c(C{H}_{3}COO)}{c(N{a}^{+})}$=1 | |
| D. | 向含有BaSO4、BaCO3的饱和溶液中加入少量的Ba(NO3)2,溶液中的$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯胺的水解产物为NH2OH(羟氨)和HCl | B. | 氯胺的电子式为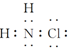 | ||
| C. | 氯胺中氯的化合价为+1价 | D. | 氯胺的消毒原理与漂白粉相似 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com