
| A. | 在任何条件下,化学平衡常数都是一个定值 | |
| B. | 当改变反应物的浓度时,化学平衡常数会发生改变 | |
| C. | 化学平衡常数K只与温度有关,与反应物浓度、体系的压强无关 | |
| D. | 化学平衡常数K可以推断一个可逆反应进行的程度 |
分析 平衡常数指各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,化学平衡常数只与温度有关,与浓度、压强无关,平衡常数越大,说明可逆反应进行的程度越大.
解答 解:A、化学平衡常数只受温度影响,同一反应温度不同,平衡常数不同,故A错误;
B、同一反应,平化学衡常数只受温度影响,与反应物的浓度无关,故B错误;
C、同一反应,平化学衡常数只受温度影响,与反应物浓度、体系的压强无关,故C正确;
D、平衡常数越大,说明可逆反应进行的程度越大,故D正确;
故选CD.
点评 本题考查了化学平衡常数、影响因素及应用,难度不大,注意化学平衡常数只与温度有关,同一转化关系化学计量数不同,平衡常数不同,温度相同,同一可逆反应的正、逆反应平衡常数互为倒数.


科目:高中化学 来源: 题型:选择题
| A. | 加催化剂 | B. | 扩大容器体积 | C. | 升高温度 | D. | 增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极的电极反应式为 Li-e-=Li+ | |
| B. | 正极的电极反应式为2SOCl2+4e-=SO2+S+4Cl- | |
| C. | 若电解液中含有水,则该电池的效率将大大降低 | |
| D. | 若负极有14gLi参加反应,则理论上流过电路中的电子书约为1.204×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氯气通入石灰乳中,制取漂白粉 | |
| B. | 自来水厂可用明矾对水进行消毒杀菌 | |
| C. | 实验室保存氯化铁溶液时加少量盐酸,目的是防止Fe3+水解 | |
| D. | 常温下浓硝酸与铝、铁均不反应,可用铝或铁制的容器存放浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K、Cl-、MnO4-、SO42- | B. | Na+、SO42-、NO3-、CO32- | ||
| C. | Na+、NO3-、SO42-、HCO3- | D. | Ca2+、SO42-、S2-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
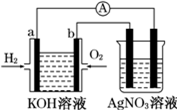 化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,46gNO2与N2O4的混合气体中含有的原子数为3NA | |
| B. | 15.6g Na2O2与过量CO2反应时,转移的电子数为0.4NA | |
| C. | 常温常压下,11.2L二氧化硫中所含的氧原子数等于NA | |
| D. | 1L1mol•L-1的Na2CO3溶液中含有NA个CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 碳 | 氮 | Y | ||
| 铝 | X | 硫 | Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、Na+、SO42-、NO3- | B. | Na+、K+、Al3+、NO3- | ||
| C. | K+、Mg2+、Cl-、SO42- | D. | NH4+、Cl-、K+、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com