
【题目】20℃时,将足量的BaSO4固体溶于50mL水中,充分搅拌,慢慢加入Na2CO3固体,搅拌,溶液中随c(CO32-)增大时c(Ba2+)变化曲线如下图。则下列说正确的是

A. 20℃时Ksp(BaSO4)>Ksp(BaCO3)
B. 加入Na2CO3固体立即有BaCO3固体生成
C. BaCO3的Ksp=2.5×10-10
D. 曲线BC段内,c(CO32-):c(SO42-)=25
【答案】D
【解析】A.当溶液中c(CO32-)=2.5×10—4mol/L时,溶液中Ba2+的浓度没有下降,则此时c(Ba2+)=c(SO42-)=1.0×10-5mol/L,故BaSO4的Ksp= c(Ba2+)×c(SO42-)=1.0×10-5×1.0×10-5 =1.0×10-10,BaCO3的Ksp= c(Ba2+)×c(CO32-)=1.0×10-5×2.5×10-4=2.5×10-9,所以20℃时,Ksp(BaSO4)<Ksp(BaCO3),故A错误;B. 由图可知,开始加入Na2CO3固体时,溶液中Ba2+的浓度并没有下降,因此开始时没有BaCO3固体生成,故B错误;C. 由A项分析可知,BaCO3的Ksp=2.5×10-9,故C错误;D . 曲线BC段内,BaCO3和BaSO4在溶液中都达到了平衡状态,则![]() =
= ![]() =
= ![]() =
=![]() =25,故D正确;答案选D。
=25,故D正确;答案选D。


 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:
【题目】以下为制取有机物Z的反应,下列说法正确的是
![]()
A. X、Y均能发生取代反应,Z不能发生 B. X、Y、Z中只有X的所有原子可能共面
C. X、Y均可作为合成聚合物的单体 D. Y的同分异构体的数目只有2种(不包括本身)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的数值,下列说法不正确的是
A. 标准状况下,1.12L 1H2和0.2g2H2均含有0.1NA个质子
B. 1mol Na2CO3晶体中含有的CO32-数目一定为NA
C. 常温常压下,92g NO2和N2O4的混合气体中含有的原子数为6NA
D. 惰性电极电解饱和食盐水,若电路中通过NA个电子,则阳极产生气体11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已准确称量过的氢氧化钠固体配制0.20 mol·L-1的氢氧化钠溶液250 mL,要用到的仪器是( )
①250 mL容量瓶 ②托盘天平 ③烧瓶 ④胶头滴管 ⑤烧杯 ⑥玻璃棒 ⑦试管 ⑧药匙
A. ①④⑤⑥ B. ①②④⑤
C. ①②④⑤⑥⑧ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 100mL MgCl2 和 AlCl3 混合溶液中,c(Cl-)=1.2mol/L,c(Mg2+)=0.3mol/L。欲使 Mg2+全部沉淀而分离出来,至少需 4 mol/L NaOH 溶液( )
A. 25mL B. 30mL C. 35mL D. 100mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式错误的是( )
A.向碳酸氢钙溶液中加过量氢氧化钠Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
B.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3·H2O+H2O
C.氢氧化铝与足量盐酸反应 Al(OH)3+3H+=Al3++3H2O
D.过量CO2通入氢氧化钠溶液中 CO2+2OH-=CO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是 ( )
A. HF、HCl、H2S、PH3的稳定性依次增强
B. 按Mg、Si、N、F的顺序,原子半径由小变大
C. 某主族元素的电离能I1~I7数据如下表所示(单位:kJ/mol),可推测该元素位于元素周期表第ⅤA族

D. 在①P、S,②Mg、Ca,③Al、Si三组元素中,每组中第一电离能较大的元素的原子序数之和为41
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实现下列物质之间的转化,需要加入还原剂才能实现的是( )
A. HCl→Cl2 B.Cl2→HClOC.Na→Na2OD.CuSO4 → Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类共同关注的重要问题。页岩气是从页岩层中开采出来的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应 CH4(g)+H2O(g)=CO(g)+3H2(g)△H1
已知:①CH4、H2、CO 的燃烧热(△H)分别为-a kJmol-1、-b kJmol-1、-c kJmol-1;
②H2O (l) =H2O(g); △H=+dkJmol-1
则△H1= ___________(用含字母a、b、c、d的代数式表示)kJmol-1。
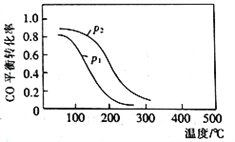
(2)用合成气生成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200℃时n(H2)随时间的变化如下表所示:
CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200℃时n(H2)随时间的变化如下表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①△H2_________ (填“>”“<”或“ = ”)0。
②下列说法正确的是____________ (填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
③ 03 min内用CH3OH表示的反应速率v(CH3OH)=________mol L-1·min-1。
④ 200℃时,该反应的平衡常数K =_______。向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则化学平衡____________(填“正向”、“逆向”或“不”)移动。
(3)甲烷、氧气和KOH溶液可组成燃料电池。标准状况下通入5.6 L甲烷,测得电路中转移1.2 mol电子,则甲烷的利用率为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com