(2013?肇庆一模)消除汽车尾气是减少城市空气污染的热点研究课题.
(1)汽车内燃机工作时发生的反应N
2(g)+O
2(g)?2NO(g),生成的NO是汽车尾气的主要污染物.T℃时,向5L密闭容器中充入6.5molN
2和7.5molO
2,在5min时反应达到平衡状态,此时容器中NO的物质的量是5mol(不考虑后续反应).则:
①5min内该反应的平均速率ν(NO)=
0.2mol?L-1?min-1
0.2mol?L-1?min-1
;在T℃时,该反应的平衡常数K=
1.25
1.25
.
②反应开始至达到平衡的过程中,容器中下列各项发生变化的是
cd
cd
(填序号).
a.混合气体的密度 b.混合气体的压强
c.正反应速率 d.单位时间内,N
2和NO的消耗量之比
(2)用H
2或CO催化还原NO可以达到消除污染的目的.
已知:2NO(g)=N
2(g)+O
2(g)△H=-180.5kJ?mol
-12H
2O(l)=2H
2(g)+O
2(g)△H=+571.6kJ?mol
-1则H
2(g)与NO(g)反应生成N
2(g)和H
2O(l)的热化学方程式是
2H2(g)+2NO(g)=N2(g)+2H2O(l)△H=-752.1kJ?mol-1
2H2(g)+2NO(g)=N2(g)+2H2O(l)△H=-752.1kJ?mol-1
.
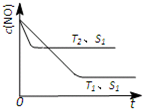
(3)当质量一定时,增大固体催化剂的表面积可提高化学反应速率.如图表示在其他条件不变时,反应2NO(g)+2CO(g)?2CO
2(g)+N
2(g)
中,NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线.
①该反应的△H
<
<
0 (填“>”或“<”).
②若催化剂的表面积S
1>S
2,在图中画出c(NO) 在T
1、S
2条件下达到平衡过程中的变化曲线(并作相应标注).



 (2013?肇庆一模)消除汽车尾气是减少城市空气污染的热点研究课题.
(2013?肇庆一模)消除汽车尾气是减少城市空气污染的热点研究课题.