
| A. | 1molNa2O2中所含的中子数为42NA | |
| B. | 9.8g由H2SO4和H3PO4组成的混合物中含有的氧原子数为0.4NA | |
| C. | 2mol•L-1的FeCl3溶液溶液中含有的Fe3+数目小于2NA | |
| D. | 1mol环己烷中含有的共价键数为12NA |
分析 A.1mol过氧化钠中含有40mol中子;
B.摩尔质量都是98g/mol,分子式中都含有4个氧原子;
C.溶液体积未知;
D.1个己烷分子含有12个C-H,5个C-C键,共含有17个共价键.
解答 解:A.1molNa2O2中所含的中子数为40NA,故A错误;
B.9.8g由H2SO4和H3PO4组成的混合物物质的量为:$\frac{9.8g}{98g/mol}$=0.1mol,含有的氧原子数为0.4mol,个数为0.4NA,故B正确;
C.溶液体积未知,依据n=CV可知,无法计算微粒的数目,故C错误;
D.1mol环己烷中含有的共价键数为17NA,故D错误;
故选:B.
点评 本题考查阿伏加德罗常数的有关计算和判断,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 冰融化时,分子中H-O键发生断裂 | |
| B. | 原子晶体中,共价键越强,熔点越高 | |
| C. | 分子体中,共价键键能越大,该分子晶体的熔、沸点一定越高 | |
| D. | 分子晶体中,分子间作用力越大,该物质越稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用葡萄糖制镜或保温瓶胆 | B. | 用Na2S除去废水中的Hg2+ | ||
| C. | 用Na2SiO3溶液制备木材防火剂 | D. | 用K2FeO4作为高效水处理剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核内有10个中子的氧原子:818O | |
| B. | HF的电子式:H+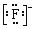 | |
| C. | Cl-离子的结构示意图: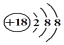 | |
| D. | N2的结构式::N≡N: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
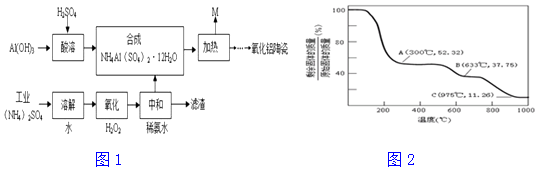
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
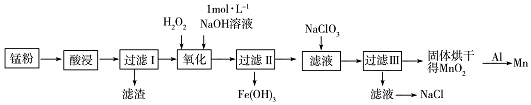
 ,NaClO3中所含的化学键类型有离子键和共价键.
,NaClO3中所含的化学键类型有离子键和共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其他分散系的本质特征是胶体可发生丁达尔效应 | |
| B. | 在一定温度和压强下,气体体积主要取决于气体分子之间的平均间距 | |
| C. | 摩尔质量与物质的量的多少有关,它等于物质的质量除以物质的量 | |
| D. | 确定物质中是否含有C、H、O、N、Cl、Br、S等元素可用元素分析仪,确定物质中是否含有哪些金属元素可用原子吸收光谱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com