
分析 根据根据n=$\frac{m}{M}$和n=$\frac{V}{{V}_{m}}$计算H2O、CO2的物质的量,根据原子守恒计算有机物分子中C、H原子数目,再结合有机物的相对分子质量计算有机物分子中氧原子数目,进而确定有机物的分子式.
解答 解:36g H2O的物质的量=$\frac{36g}{18g/mol}$=2mol,则(H)=2mol×2=4mol,44.8LCO2 的物质的量=$\frac{44.8L}{22.4L/mol}$=2mol,n(C)=2mol,
故有机物分子中N(H)=$\frac{4mol}{1mol}$=4、N(C)=$\frac{2mol}{1mol}$=2,故N(O)=$\frac{60-4-12×2}{16}$=2,则有机物的分子式为C2H4O2,
答:该有机物的分子式为C2H4O2.
点评 本题考查有机物分子式的确定,为高频考点,侧重于学生分析、计算能力的考查,难度不大,注意掌握燃烧法利用元素原子守恒确定有机物的分子式.


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:实验题
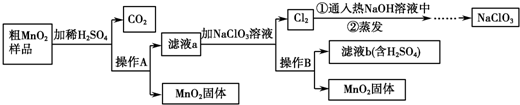
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠融化成银白色小球 | B. | 小球在液面上快速游动 | ||
| C. | 溶液底部出现银白色固体 | D. | 溶液变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
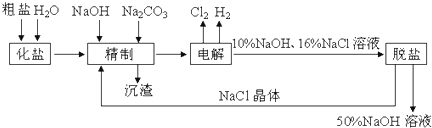
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ②、⑧、⑨对应简单离子半径依次减小 | |
| B. | ⑤的三种核素化学性质不同 | |
| C. | 元素=10 ⑩处于常见周期表第四周期第VIIIB族 | |
| D. | ④的最高价氧化物对应的水化物能与其氢化物反应,生成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠的电子式: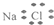 | B. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | ||
| C. | NH3的电子式: | D. | S2-的结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | IO${\;}_{4}^{-}$作氧化剂 | |
| B. | 氧化性:Mn2+>IO${\;}_{3}^{-}$ | |
| C. | 氧化剂与还原剂的物质的量之比为5:2 | |
| D. | 若有2mol Mn2+参加反应,则转移10mol电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com