
| A. | 35Cl和37Cl-质子数、中子数均不相同 | |
| B. |  的名称为2,2-甲基丙烷 的名称为2,2-甲基丙烷 | |
| C. | H2O与D2O互为同素异形体 | |
| D. | (CH3)2CHCH2CH(CH3)2分子中一个氢原子被氯原子取代后的结构有3种 |
分析 A.氯元素质子数相同,质子数+中子数=质量数;
B.取代基数目需要标注;
C.同种元素组成的不同单质为同素异形体;
D.有机物分子中含氢原子种类多少,一氯取代物多少.
解答 解:A.35Cl和37Cl-质子数相同为17,中子数不相同,分别为35-17=18、37-17=20,故A错误;
B. 正确的名称为2,2-二甲基丙烷,故B错误;
正确的名称为2,2-二甲基丙烷,故B错误;
C.H2O与D2O不是单质,不互为同素异形体,故C错误;
D.(CH3)2CHCH2CH(CH3)2分子中含三种氢原子,一个氢原子被氯原子取代后的结构有3种,故D正确;
故选D.
点评 本题考查了原子结构、同素异形体、烷烃命名、同分异构体等知识,掌握基础是解题关键,题目难度中等.


 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:选择题

| A. | 该装置能将化学能转化为电能 | B. | 电流由锌片流向铜片 | ||
| C. | 负极反应为 Zn-2e-═Zn2+ | D. | Cu为正极材料,正极发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性氧化物:Na2O、CaO、Mn2O7、Na2O2 | |
| B. | 碱:NaOH、KOH、Ba(OH)2、Na2CO3 | |
| C. | 铵盐:NH4Cl、NH4NO3、(NH4)2SO4、NH3•H2O | |
| D. | 氧化物:CO2、NO、SO2、H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钾溶于水时离子键未被破坏 | B. | 原子晶体中共价键越强,熔点越高 | ||
| C. | 晶体中有阳离子必含阴离子 | D. | 分子间作用力越大,分子越稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | x=4 | |
| B. | 达到平衡状态时A的转化率为50% | |
| C. | 5s内B的反应速率v(B)=0.05 mol/(L•s) | |
| D. | 达到平衡状态时容器内气体的压强与起始时压强比为5:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ①④ | C. | ②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
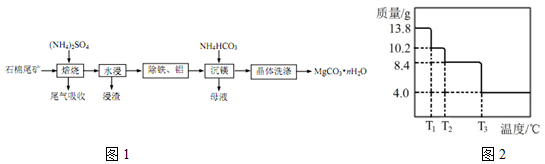
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com