
| A. | 1 mol 氢气和1 mol碘蒸气完全反应需要吸收26 kJ的热量 | |
| B. | 1个氢分子和1个碘分子完全反应需要吸收52 kJ的热量 | |
| C. | 1 mol H2(g)与1 mol I2(g)完全反应生成 2 mol的HI气体需吸收52 kJ的热量 | |
| D. | 1 mol H2(g)与1 mol I2(g)完全反应放出26 kJ的热量 |
分析 A.焓变值是正值表明反应为吸热反应;
B.热化学方程式中各物质的系数表示物质的量,不能表示微粒的数目;
C.$\frac{1}{2}$mol氢气和$\frac{1}{2}$mol碘单质气体完全反应生成1molHI吸手热量26KJ,则1 mol氢气和1 mol碘蒸气完全反应需要吸收52 kJ的热量;
D.焓变值是正值表明反应为吸热反应.
解答 解:A.$\frac{1}{2}$mol氢气和$\frac{1}{2}$mol碘单质气体完全反应生成1molHI吸手热量 26KJ,1 mol氢气和1 mol碘蒸气完全反应需要吸收52 kJ的热量,故A错误;
B.热化学方程式的系数表示物质的量的多少,不表示分子的数目,故B错误;
C.$\frac{1}{2}$mol氢气和$\frac{1}{2}$mol碘单质气体完全反应生成1molHI吸手热量26KJ,则:1molH2(g)与1molI2(g)完全反应生成2mol的HI气体需吸收52kJ的热量,故C正确;
D.热化学方程式 H2(g)+I2(g)═2HI(g)△H=+52kJ•mol-1中,焓变值是正值,表明反应为吸热反应,不会放出热量,故D错误;
故选C.
点评 本题考查热化学方程式,题目难度不大,明确热化学方程式的含义以及热化学方程式的书写原则为解答关键,试题侧重基础知识的考查,培养了学生的分析、理解能力及灵活应用.


科目:高中化学 来源: 题型:选择题
| A. | 稀醋酸中加入少量醋酸钠固体减小醋酸的电离程度 | |
| B. | 0.02 mol•L-1HCl溶液与0.02 mol•L-1Ba(OH)2溶液等体积混合后,溶液pH约为12 | |
| C. | 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 | |
| D. | pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸可以使蛋白质变黄,称为颜色反应,该过程为物理变化 | |
| B. | 某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性 | |
| C. | 酯化反应是可逆反应,为了提高反应速率,一般加入浓硫酸做催化剂 | |
| D. | 油脂在碱性条件下的水解反应称为皂化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5mol•L-1 | |
| B. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| C. | pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合,混合液的pH>7 | |
| D. | a1mLb1mol•L-1盐酸和a2mLb2mol•L-1氨水混合至中性,b1=b2,则a1<a2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用10mL量筒量取10.1mL盐酸 | |
| B. | 用100mL量筒量取15.2mL盐酸 | |
| C. | 用托盘天平秤取25.20gNaCl | |
| D. | 用100mL容量瓶配制90mL0.10mol/LNaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12g金刚石中所含的共价键数为4NA | |
| B. | 标准状况下,11.2L SO3所含的氧原子数为1.5NA | |
| C. | 常温下,1L0.1mol/L的NH4NO3溶液中铵根离子为0.1 NA | |
| D. | 1mol 过氧化氢分解转移NA电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ETFE分子中可能存在“-CH2-CH2-CF2-CF2-”的连接方式 | |
| B. | 合成ETFE及合成聚全氟乙丙烯的反应均为加聚反应 | |
| C. | 聚全氟乙丙烯分子的结构简式可能为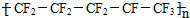 | |
| D. | 四氟乙烯中所有原子均在同一平面内 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 .
.

 ;吡啶与混酸(浓硝酸与浓硫酸混合物)在加热条件下,发生硝化反应生成氮原子间位的一取代物的化学方程式为
;吡啶与混酸(浓硝酸与浓硫酸混合物)在加热条件下,发生硝化反应生成氮原子间位的一取代物的化学方程式为 .
.
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com