
【题目】Na2S2O3·5H2O常用作冲洗照相底片的定影剂,实验室以Na2S、Na2CO3、SO2为原料,利用下图装置可制取少量Na2S2O3·5H2O,其实验原理为Na2CO3+SO2=Na2S2O3+CO2;2Na2S+3SO2==2Na2SO3+3S;Na2SO3+S=Na2S2O3。回答下列问题:
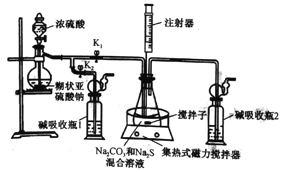
(1)打开K1,关闭K2,将锥形瓶中的溶液加热至35℃,打开滴液漏斗活塞慢慢滴加浓硫酸,锥形瓶中的现象是: ①导管口有气泡冒出;②__________________。
(2)通过注射器取样,监控锥形瓶中溶液pH=7~8,锥形瓶中酸性不能过强的原因是_______。当锥形瓶中溶液的pH接近7时,应进行的操作是__________________________。
(3)反应结束后将锥形瓶中混合液经如下处理可Na2S2O3·5H2O粗晶体:
![]()
①趁热过滤的目的是______________________。
②粗晶体中含有Na2CO3、Na2SO3、Na2SO4等杂质,利用下列提供的试剂,检验粗产品中含有Na2CO3。
可选试剂: a.品红溶液 b.酸性高锰酸钾溶液 c.澄清石灰水 d.NaOH溶液 e.稀硫酸
实验方案:取适量所得粗晶体配成溶液,滴加足量的稀硫酸,将产生的气体依次通过酸性高锰酸钾溶液、_____(填试剂序号)、澄清石灰水,若______(填现象),则证明产品中含有Na2CO3。
(4)粗晶体中Na2S2O3·5H2O质量分数的测定:称取2.500g粗晶体溶于水,配成100mL溶液,取25.00mL溶液于锥形瓶中,用0.4000 mol/L的酸性高锰酸钾标准溶液滴定,消耗标准溶液的体积为10.00mL,Na2S2O3·5H2O的质量分数为______ (忽略杂质对滴定的影响;S2O32-被酸性高锰酸钾溶液氧化为SO42-)。
【答案】 溶液中出现黄色浑浊(或淡黄色),后又逐渐变澄清 Na2S2O3在酸性较强的环境中会发生反应,降低Na2S2O3·5H2O产率 关闭滴液漏斗活塞,关闭K1,打开K2 防止Na2S2O3因温度降低析出,而造成损失 a 酸性高锰酸钾溶液颜色变浅,品红溶液不褪色,澄清石灰水变浑浊 99.2%
【解析】(1)打开K1,关闭K2,将锥形瓶中的溶液加热至35℃,打开滴液漏斗活塞慢慢滴加浓硫酸,亚硫酸钠与浓硫酸反应生成二氧化硫气体,二氧化硫与硫化钠反应生成硫单质,2Na2S+3SO2==2Na2SO3+3S;随后有发生Na2SO3+S=Na2S2O3,溶液变澄清,故答案为:溶液中出现黄色浑浊(或淡黄色),后又逐渐变澄清;
(2)通过注射器取样,监控锥形瓶中溶液pH=7~8,因为Na2S2O3在酸性较强的环境中会发生反应,会降低Na2S2O3·5H2O产率,因此锥形瓶中酸性不能过强;当锥形瓶中溶液的pH接近7时,需要关闭滴液漏斗活塞,使反应停止,同时关闭K1,打开K2,用碱液吸收多余的二氧化硫,故答案为:Na2S2O3在酸性较强的环境中会发生反应,降低Na2S2O3·5H2O产率;关闭滴液漏斗活塞,关闭K1,打开K2;
(3)①趁热过滤可以防止Na2S2O3因温度降低析出,而造成损失,故答案为:防止Na2S2O3因温度降低析出,而造成损失;
②检验粗产品中含有Na2CO3:取适量所得粗晶体配成溶液,滴加足量的稀硫酸,将产生的气体依次通过酸性高锰酸钾溶液、除去二氧化硫,然后用品红溶液检验二氧化硫是否除净,再用澄清石灰水具有生成的二氧化碳,若酸性高锰酸钾溶液颜色变浅,品红溶液不褪色,澄清石灰水变浑浊,则证明产品中含有Na2CO3,故答案为:a;酸性高锰酸钾溶液颜色变浅,品红溶液不褪色,澄清石灰水变浑浊;
(4) 酸性高锰酸钾标准溶液滴定Na2S2O3·5H2O的反应方程式为5S2O32-+ 8MnO4-+ 14H+= 10SO42-+8 Mn2++7H2O,反应消耗的高锰酸钾的物质的量为0.4000mol/L×0.0100L=0.004mol,则n(S2O32-)=![]() ×0.004mol=0.0025mol,因此Na2S2O3·5H2O的质量分数=
×0.004mol=0.0025mol,因此Na2S2O3·5H2O的质量分数=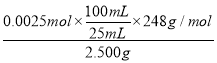 ×100%=99.2%,故答案为:99.2%。
×100%=99.2%,故答案为:99.2%。


科目:高中化学 来源: 题型:
【题目】高分子合物J的合成路线如下:

已知:i、
ii、
(1)写出E的名称:_____________,由G生成H的反应类型为:______________。
(2)I中官能团名称:____________________。B→C的反应条件为:___________。
(3)由I可合成有机物K,K中含有3个六元环,写出I合成K的化学方程式:____________________________________________________。
(4)D→E反应的化学方程式:_____________________________。
(5)有机物L(C9H10O3)符合下列条件的同分异构体有______种。
①与FeCl3溶液发生显色反应
②与I具有相同的官能团
③苯环上有3个取代基
(6)结合上述流程中的信息,设计由![]() 制备
制备 的合成路线_____。合成路线流程图示例:
的合成路线_____。合成路线流程图示例:![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某同学利用注射器设计的简易实验装置。甲管中吸入10 mL CH4,同温同压下乙管中吸入50 mL Cl2,将乙管气体推入甲管中,将注射器用日光照射一段时间。
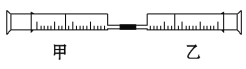
(1)下列是某同学预测的实验现象:
①气体最终变为无色;
②实验过程中,甲管活塞向内移动;
③甲管内壁有油珠;
④产生火花。
其中正确的是 。
(2)甲管中发生的化学反应类型为 。
(3)反应后,甲管中剩余气体最好用下列的 吸收。
A.水 B.氢氧化钠溶液
C.硝酸银溶液 D.饱和食盐水
(4)反应后,若将甲管中的物质推入盛有适量AgNO3溶液的小试管中会观察到 ,若用pH试纸测量甲管中溶液的酸碱性,可观察到pH试纸变 色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组研究影响锌与稀硫酸反应速率的外界条件,设计实验的数据如下:
实验序号 | 锌的质量/g | 锌的状态 | c(H2SO4)/mol·L-1 | V(H2SO4)/mL | 反应前溶液的温度/℃ | 其他试剂 |
1 | 0.65 | 粒状 | 0.5 | 50 | 20 | 无 |
2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
3 | 0.65 | 粒状 | 0.5 | 50 | 20 | 2滴CuSO4溶液 |
4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
5 | 0.65 | 粉末 | 0.8 | 50 | 35 | 2滴CuSO4溶液 |
(1)在此5组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过测定 进行判断,其速率最快的是 (填实验序号)。
(2)实验1和2表明 对反应速率有影响;实验1和3表明 对反应速率有影响。
(3)进行实验2时,小组同学根据实验过程绘制的氢气体积(标准状况下)与时间的关系如图所示。
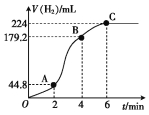
①在OA、AB、BC三段中反应速率最快的是 ,其原因是 。
②2~4 min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)v(H2SO4)= mol·L-1·min-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2 mol A与2 mol B混合于2 L的密闭容器中,发生反应:2A(g)+3B(g)![]() 2C(g)+zD(g),若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是( )
2C(g)+zD(g),若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是( )
A.v(C)=0.2 mol·L-1·s-1
B.z=3
C.B的转化率为25%
D.C平衡时的浓度为0.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是反应:2SO2+O2![]() 2SO3在不同条件下达到平衡状态时SO2的转化率。
2SO3在不同条件下达到平衡状态时SO2的转化率。
压强 转化率 温度 | 0.1MPa | 0.5MPa | 1MPa | 10MPa |
400℃ | 99.2% | 99.6% | 99.7% | 99.9% |
500℃ | 93.5% | 96.9% | 97.8% | 99.3% |
600℃ | 73.7% | 85.8% | 89.5% | 96.4% |
试回答下列问题。
(1)关于可逆反应的限度,你能得出什么启示?
________________________________________。
(2)提高该化学反应限度的途径有:_____________________。
(3)要实现SO2的转化率为93.5%,需控制的反应条件是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L容积不变的容器中,发生N2+3H2 ![]() 2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
A. 1.6 mol B. 2.8 mol
C. 3.2 mol D. 3.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着核电荷数的递增,氧化性逐渐减弱的一组是( )
A.I2、Br2、Cl2、F2B.F2、Cl2、Br2、I2C.F-、Cl-、Br-、I-D.Li、Na、K、Rb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫化合物的种类很多,现有H2SO4、H2SO3、SO2、Na2SO3、BaSO4、CuSO4、Na2SO4这7种常见的含硫化合物。回答下列问题:
(1)H2SO3转化为硫酸是酸雨形成的重要过程之一,写出其反应的化学方程式,并标明电子转移的方向和数目:_______________________________________。
(2)常温下,将铁棒置于浓硫酸中,无明显现象,课本上解释为发生了钝化,但有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面_______________________,则发生了钝化;若铁棒表面____________________,则未发生反应。
(3)用Na2SO3吸收法是治理SO2污染的一种方法,其原理为(用化学方程式表示): _______________________________________________________________。
(4)减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2,该反应的化学方程式:______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com