
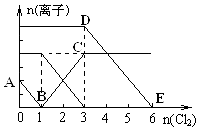
 已知:2Fe3++2I-=2Fe2++I2,向1L含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.横、纵坐标的单位均为mol.有关说法不正确的是( )
已知:2Fe3++2I-=2Fe2++I2,向1L含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.横、纵坐标的单位均为mol.有关说法不正确的是( )| A. | 线段BC代表Fe3+ 物质的量的变化情况 | |
| B. | 原混合溶液中c(FeBr2)=6 mol/L | |
| C. | 当通入Cl22mol时,溶液中已发生的反应可表示为2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | |
| D. | 原溶液中n (Fe2+):n (I-):n(Br-)=2:1:3 |
分析 还原性为I->Fe2+>Br-,则先发生2I-+Cl2═I2+2Cl-,I-反应完毕再发生2Fe2++Cl2═2Fe3++2Cl-,最后发生反应2Br-+Cl2═Br2+2Cl-,
A.B点时溶液中I-完全反应,溶液中存在Fe2+和Br-,BC段发生2Fe2++Cl2═2Fe3++2Cl-;
B.根据BC段消耗的氯气的物质的量,计算溶液n(Fe2+);
C.根据反应消耗顺序,利用消耗的氯气计算参加反应的离子的物质的量;
D.根据各阶段消耗的氯气的物质的量,计算原溶液中n(Fe2+)、n(I-)、n(Br-).
解答 解:还原性为I->Fe2+>Br-,则先发生2I-+Cl2═I2+2Cl-,I-反应完毕再发生2Fe2++Cl2═2Fe3++2Cl-,最后发生反应2Br-+Cl2═Br2+2Cl-,
A.B点时溶液中I-完全反应,溶液中存在Fe2+和Br-,BC段发生2Fe2++Cl2═2Fe3++2Cl-,代表Fe3+的物质的量的变化情况,故A正确;
B.由图可知,BC段发生2Fe2++Cl2═2Fe3++2Cl-,Fe2+反应完毕消耗氯气2mol,由方程式可知n(Fe2+)=2×2mol=4mol,则n(FeBr2)=4mol,故B错误;
C.AB段发生2I-+Cl2═I2+2Cl-,2mol的I-消耗1mol氯气,BC段发生2Fe2++Cl2═2Fe3++2Cl-,余下的1mol氯气再与2molFe2+反应,故参加反应的n(Fe2+):n(I-)=1:1,故通入2molCl2时,溶液中已发生的离子反应可表示为2Fe2++2I-+2Cl2═2Fe3++I2+4Cl-,故C正确;
D.由图可知AB段消耗氯气1mol,发生2I-+Cl2═I2+2Cl-,故n(I-)=2n(Cl2)=2mol,BC段发生2Fe2++Cl2═2Fe3++2Cl-,消耗氯气2mol,故n(Fe2+)=2n(Cl2)=2×2mol=4mol,DE段发生2Br-+Cl2═Br2+2Cl-,消耗氯气3mol,故n(Br-)=2n(Cl2)=6mol,故原溶液中n(Fe2+):n(I-):n(Br-)=4mol:2mol:6mol=2:1:3,故D正确;
故选B.
点评 本题以图象形式考查氧化还原反应、化学计算,试题综合性较强,根据离子的还原性强弱结合图象判断各阶段发生的反应是解答该题的关键,为易错题目.本题难度较大,是难题.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:选择题

| A. | 电解池装置应选择阳离子交换膜 | |
| B. | d 极的电极反应式为:O2+2e-+2H+=H2O2 | |
| C. | 当有16g甲烷参与原电池反应时,可制备4 mol H2O2 | |
| D. | 工作时,a、c电极附近的pH均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 近年来AIST报告正在研制一种“高容量、低成本”的锂一铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )
近年来AIST报告正在研制一种“高容量、低成本”的锂一铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )| A. | 放电时,Li+透过同体电解质向Cu极移 | |
| B. | 放电时,正极的电极反应式为O2+2H2O+4e-=4OH- | |
| C. | 通空气时,铜被腐蚀,表面产生Cu2O | |
| D. | 通空气时,整个反应过程中,铜相当于是催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在稀氨水中,丁二酮肟(CH3C=N-OH)2与Ni2+反应可生成鲜红色沉淀丁二酮肟镍(结构如图),常用于检验Ni2+.
在稀氨水中,丁二酮肟(CH3C=N-OH)2与Ni2+反应可生成鲜红色沉淀丁二酮肟镍(结构如图),常用于检验Ni2+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )| 选项 | W | X |
| A | 稀硫酸 | Na[Al(OH)4]溶液 |
| B | 稀硝酸 | Fe |
| C | CO2 | Ca(OH)2溶液 |
| D | Cl2 | Fe |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下,某可逆反应在某体积为5L的密闭容器中进行,在从0-3分钟各物质的量的变化情况如图所示(A,B,C均为气体)
一定温度下,某可逆反应在某体积为5L的密闭容器中进行,在从0-3分钟各物质的量的变化情况如图所示(A,B,C均为气体)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
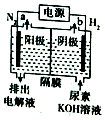 用如图所示的装置,采用廉价的镍催化剂,通过电化学方法,可在碱性环境中直接使尿素转化成纯氢,电极为惰性电极,隔膜仅阻止气体通过,下列相关叙述不正确的是( )
用如图所示的装置,采用廉价的镍催化剂,通过电化学方法,可在碱性环境中直接使尿素转化成纯氢,电极为惰性电极,隔膜仅阻止气体通过,下列相关叙述不正确的是( )| A. | 尿素由碳、氮、氧、氢四种元素组成的有机化合物 | |
| B. | 尿素在阳极被氧化,当生成1 mol N2时,转移电子为6 mol | |
| C. | a、b两处生成的气体体积比为1:3 | |
| D. | 假设电解过程中溶液体积不变,电解后排出液的pH比通入前大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )
t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )| A. | 在t℃时,AgBr的Ksp为4.9×10-13 | |
| B. | 通过蒸发,可使溶液由a点变到c点 | |
| C. | 图中b点有AgBr沉淀析出 | |
| D. | 在t℃时,AgCl(s)+Br-(aq)?AgBr(s)+Cl-(aq)的平衡常数K≈816 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达平衡时,①途径的反应速率vA不等于②途径的反应速率vA | |
| B. | ①、②都达到平衡时,体系内混合气体的平均相对摩尔质量相同 | |
| C. | ①、②都达到平衡时,体系内混合气体的组成百分比相同 | |
| D. | 达平衡时,①途径所得混合气的密度为②途径所得混合气密度相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com