
下列实验事实不能证明醋酸是弱酸的是( )
|
| A. | 常温下,等浓度的醋酸比盐酸导电能力弱 |
|
| B. | 常温下,测得0.1 mol•L﹣1醋酸溶液的pH=4 |
|
| C. | 常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4 |
|
| D. | 常温下,将物质的量浓度相同的醋酸溶液与氢氧化钠溶液等体积混合后恰好中和 |
考点:
弱电解质的判断.
分析:
部分电离的电解质为弱电解质,要证明醋酸是弱电解质,只要证明醋酸部分电离即可,据此分析解答.
解答:
解:A.HCl是强电解质,在水溶液里完全电离,常温下,等浓度的醋酸比盐酸导电能力弱,说明醋酸电离程度小于HCl,则证明醋酸是弱电解质,故A不选;
B.常温下,测得0.1 mol•L﹣1醋酸溶液的pH=4,溶液中氢离子浓度小于醋酸浓度,说明醋酸部分电离,则证明醋酸是弱电解质,故B不选;
C.常温下,pH=1的醋酸溶液稀释1000倍,测得pH<4,说明加水稀释促进醋酸电离,醋酸中存在电离平衡,则证明醋酸是弱电解质,故C不选;
D.常温下,将物质的量浓度相同的醋酸溶液与NaOH溶液等体积混合后恰好中和,说明醋酸是一元酸,不能说明醋酸部分电离,所以不能证明醋酸是弱电解质,故D选;
故选D.
点评:
本题考查电解质强弱判断,电解质强弱只与电离程度有关,与电解质溶解性强弱无关,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列有机物命名正确的是( )
|
| A. | | B. | CH3CH2CH=CH2 1﹣丁烯 |
|
| C. | | D. | |
查看答案和解析>>
科目:高中化学 来源: 题型:
现有CH4、C2H2、C2H4、C2H6、C4H10五种有机物,质量相同时,完全燃烧消耗O2的物质的量的顺序为( )
|
| A. | CH4>C2H2>C4H10>C2H4>C2H6 | B. | CH4>C2H6>C4H10>C2H4>C2H2 |
|
| C. | C4H10>C2H6>C2H4>C2H2>CH4 | D. | C4H10>C2H6>CH4>C2H4>C2H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列热化学方程式:①Zn(s)+ O2(g)═ZnO(s);△H1;②Hg(l)+
O2(g)═ZnO(s);△H1;②Hg(l)+ O2(g)═HgO(s);△H2.则反应Zn(s)+HgO(s)═Hg(l)+ZnO(s);△H3,△H3为( )
O2(g)═HgO(s);△H2.则反应Zn(s)+HgO(s)═Hg(l)+ZnO(s);△H3,△H3为( )
|
| A. | △H1﹣△H2 | B. | △H2﹣△H1 | C. | △H1+△H2 | D. | ﹣(△H1+△H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度不同压强(P1<P2)下,可逆反应2X(g)⇌2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是( )
|
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极。

接通电源,经过一端时间后,测得乙中c电极质量增加了27克。常温下各烧杯中溶液的pH与电解时间t的关系图如上。据此回答下列问题:
(1)M为电源的 极(填写“正”或“负”),甲、乙电解质分别为 、 (填写化学式)。
(2)要使电解后丙中溶液恢复到原来的状态,应加入 物质。(填写化学式)
(3) 若电解后甲溶液的体积为25L,且产生的气体全部逸出。该溶液常温时的pH为 。
(4)写出乙烧杯中发生反应的离子方程式
(5)写出甲烧杯中发生反应的离子方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
稀土元素又称“二十一世纪黄金”,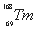 、
、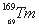 和
和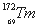 属于稀土元素,铥(Tm)可用来指导不需要电源的手提式X射线机。下列说法不正确的是
属于稀土元素,铥(Tm)可用来指导不需要电源的手提式X射线机。下列说法不正确的是
A.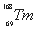 和
和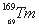 互为同位素 B.
互为同位素 B.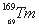 和
和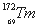 是不同的核素
是不同的核素
C.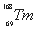 和
和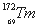 的中子数相差4 D.
的中子数相差4 D.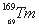 和
和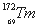 的电子数相差3
的电子数相差3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中铁元素被还原的是()
A. 2Fe(OH)3 Fe2O3+3H2O B. Fe+CuSO4=Cu+FeSO4
Fe2O3+3H2O B. Fe+CuSO4=Cu+FeSO4
C. Fe(OH)3+3HCl=FeCl3+3H2O D. 2Fe2O3+3C 4Fe+3CO2↑
4Fe+3CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com