
| A. | C2H4Cl2 | B. | C2H3Cl3 | C. | C2HCl3 | D. | C2H2Cl2 |
分析 纯净物是由同一种物质组成,根据分子式是否存在同分异构体进行解答.同分异构体是分子式相同,但结构不同的化合物.
解答 解:A.C2H4Cl2中2个氯原子可以连接在同一碳原子上,为1,1-二氯乙烷;每个碳原子分别连接1个氯原子,为1,2-二氯乙烷,不能表示纯净物,故A错误;
B.C2H3Cl3中3个氯原子可以连接在同一碳原子上,为1,1,1-三氯乙烷;每个碳原子分别连接1个氯原子,2个氯原子,为1,1,2-三氯乙烷,不能表示纯净物,故B错误;
C.C2HCl3只有一种结构,每个碳原子分别连接1个氯原子,2个氯原子,为1,1,2-三氯乙烯,不存在同分异构体,故C正确;
D.C2H2Cl2中2个氯原子可以连接在同一碳原子上,为1,1-二氯乙烯;每个碳原子都连接1个氯原子,为1,2-二氯乙烯,不能表示纯净物,故D错误.
故选:C.
点评 本题以纯净物为载体考查了同分异构现象,难度不大,注意纯净物必须是由同一种物质组成.


科目:高中化学 来源: 题型:选择题
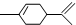 ,下列有关萜二烯的推测不正确的是( )
,下列有关萜二烯的推测不正确的是( )| A. | 萜二烯属于芳香烃 | B. | 萜二烯难溶于水 | ||
| C. | 萜二烯能发生加聚反应 | D. | 萜二烯能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl具有很强的酸性,所以氯元素的非金属性很强 | |
| B. | ${\;}_{17}^{35}$Cl、${\;}_{17}^{37}$Cl为不同的核素,有不同的化学性质 | |
| C. | 1.12LCl2含有1.7NA个质子(NA 表示阿伏加德罗常数) | |
| D. | 氯气可从KI溶液中置换出I2,说明氯的非金属性比碘强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{15}^{30}P$→${\;}_{14}^{30}Si$+x | B. | ${\;}_{7}^{14}N{+}_{0}^{1}n$→${\;}_{6}^{14}C$+x | ||
| C. | ${\;}_{27}^{60}Co$→${\;}_{28}^{60}Ni$+x | D. | ${\;}_{13}^{27}Al{+}_{2}^{4}He$→${\;}_{15}^{30}P$+x |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物理量 编号 | V(0.20mol/L H2C2O4溶液)/mL | 甲 | V(O.O1mol/L KMnO4溶液)/mL | M(MnSO4固体)/g | T/℃ | 乙 |
| ① | 2.0 | 0 | 4.0 | 0 | 5.0 | |
| ② | 2.0 | 0 | 4.0 | 0 | 2.5 | |
| ③ | 1.0 | a | 4.0 | 0 | 2.5 | |
| ④ | 2.0 | 0 | 4.0 | 0.1 | 2.5 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 酸 | CH3COOH | HCN | HF | H2CO3 |
| 电离常数 | 1.8×10-5 | 4.9×10-10 | 6.6×10-4 | Ka1=4.3×10-2Ka2=5.6×10-11 |
| A. | 5种钠盐溶液pH大小关系pH(Na2CO3)>pH(NaCN)>pH(NaHCO3)>pH(CH3COONa)>pH(NaF) | |
| B. | 2mol•L-1HCN与1mol•L-1NaOH溶液等体积混合后的溶液中:c(CN-)<c(Na+)<c(HCN) | |
| C. | 向Na2CO3溶液中滴加过量的HCN溶液;2HCN+Na2CO3=2NaCN+CO2↑+H2O | |
| D. | 含等物质的量的Na2CO3、NaHCO3的混合液中:2c(Na+)=3c(CO32-)+3C(HCO3-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com