
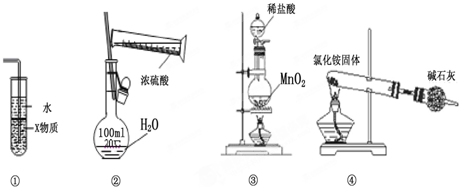
| A. | 装置中①X若为四氯化碳,则此装置可用于吸收氨气,并防止倒吸 | |
| B. | 装置②可用于实验室配制一定物质的量浓度的稀硫酸 | |
| C. | 实验室用装置③制取氯气 | |
| D. | 实验室用装置④制取氨气 |
分析 A.四氯化碳密度大于水,可以将水与氨气隔离,可以防倒吸,氨气极易溶于水,可以用水吸收氨气;
B.配制一定物质的量浓度的稀硫酸时,不能直接将浓硫酸倒入容量瓶,要在烧杯中稀释后才能转移;
C.实验室用浓盐酸与二氧化锰反应制氯气,稀盐酸不能被二氧化锰氧化;
D.氯化铵固体受热分解生成氨气和氯化氢,氨气和氯化氢在试管口又能结合生成氯化铵.
解答 解:A.四氯化碳密度大于水,可以将水与氨气隔离,可以防倒吸,氨气极易溶于水,可以用水吸收氨气,故A正确;
B.配制一定物质的量浓度的稀硫酸时,不能直接将浓硫酸倒入容量瓶,要在烧杯中稀释后才能转移,故B错误;
C.实验室用浓盐酸与二氧化锰反应制氯气,稀盐酸不能被二氧化锰氧化,故C错误;
D.氯化铵固体受热分解生成氨气和氯化氢,氨气和氯化氢在试管口又能结合生成氯化铵,所以得不到氨气,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及电解原理及应用、气体的制备及性质、稀释操作等,把握反应原理、实验基本技能为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 浓度 时间 | c(A)/mol•L-1 | c(B)/mol•L-1 | c(C)/mol•L-1 |
| 0 | 0.8 | 1.6 | 0 |
| 2min | 0.6 | x | 0.2 |
| 4min | 0.3 | 0.6 | 0.5 |
| 6min | 0.3 | 0.6 | 0.5 |
| A. | 2~4 min内用B表示的平均反应速率为0.3 mol•L-1•min-1 | |
| B. | 反应在第2 min时改变了条件,可能是加入了催化剂 | |
| C. | 反应在第2 min时改变了条件,可能是增加了B的浓度 | |
| D. | 若加入催化剂,平衡时气体混合物的总物质的量保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥②③④⑤ | B. | ①⑤⑥②③④ | C. | ⑥②③④①⑤ | D. | ②④③⑤⑥① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 698K时,向某V L的密闭容器中充入2mol H2(g)和2mol I2(g),发生反应:H2(g)+I2(g)═2HI(g),测得各物质的物质的量浓度与时间变化的关系如图所示.请回答下列问题:
698K时,向某V L的密闭容器中充入2mol H2(g)和2mol I2(g),发生反应:H2(g)+I2(g)═2HI(g),测得各物质的物质的量浓度与时间变化的关系如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的铁粉加入稀硝酸中,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀硝酸将Fe氧化为Fe2+ |
| B | AlCl3溶液中滴加过量的氨水 | 先出现白色沉淀,后沉淀又逐渐溶解 | 氢氧化铝能溶于氨水 |
| C | 铝箔插入稀硝酸中 | 无明显现象 | 铝箔表面被稀硝酸氧化形成致密的氧化膜 |
| D | 用玻璃棒蘸取浓硫酸点到pH试纸上 | 试纸变黑色 | 浓硫酸具有脱水性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的平均相对分子质量不再改变 | |
| B. | 容器内气体的总物质的量不随时间而变化 | |
| C. | D的浓度不时间变化而改变 | |
| D. | 单位时间内生成2n mol A的同时,生成n mol的B |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com