
 7N2+12H2O可处理NO2.当转移1.2mol电子时,消耗的NO2在标准状况下是______L.
7N2+12H2O可处理NO2.当转移1.2mol电子时,消耗的NO2在标准状况下是______L. 7N2+12H2O中,6NO2中N元素化合价降低,由+4价降低到0价,则6molNO2参加反应,转移24mol电子,所以当转移1.2mol电子时,消耗
7N2+12H2O中,6NO2中N元素化合价降低,由+4价降低到0价,则6molNO2参加反应,转移24mol电子,所以当转移1.2mol电子时,消耗 -②×
-②× 得NO2(g)+SO2(g)?SO3(g)+NO(g)
得NO2(g)+SO2(g)?SO3(g)+NO(g) ×(-196.6kJ?mol-1)-
×(-196.6kJ?mol-1)- ×(-113.0kJ?mol-1)=-41.8kJ?mol-1,
×(-113.0kJ?mol-1)=-41.8kJ?mol-1, a,故平衡常数K=
a,故平衡常数K= =
=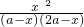 =
= =
=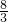 ,
,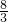 .
.

科目:高中化学 来源: 题型:
 (2011?山东)研究NO2、SO2、CO等大气污染气体的处理有重要意义.
(2011?山东)研究NO2、SO2、CO等大气污染气体的处理有重要意义.| 催化剂 | △ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
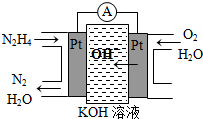 Ⅰ.肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
Ⅰ.肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题| 物质 | CO | H2 | CH3OH |
| 浓度(mol?L-1) | 0.9 | 1.0 | 0.6 |
| 2 |
| 3 |
| 2 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 加热 |
| 8 |
| 3 |
| 8 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
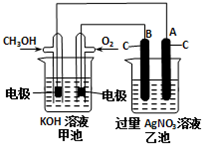 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.| 催化剂 | 加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com