
| A. | 冰镇的啤酒打开后泛起泡沫 | |
| B. | 500℃左右比室温更有利于合成氨的反应(△H<0) | |
| C. | 红棕色的NO2加压后颜色先变深再变浅(2 NO2?N2O4(无色)) | |
| D. | 光照新制的氯水时,溶液的pH逐渐减小 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动;使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用,据此进行解答.
解答 解:A.气体的溶解度随温度的升高而减小,随压强的增大而增大,由气体的溶解度随压强的增大而增大,因此常温时打开汽水瓶时,瓶内的压强减小,因此瓶内的二氧化碳会从瓶中溢出,可以用勒夏特列原理解释,故A错误;
B.合成氨反应为N2(g)+3H2(g)?2NH3(g)△H<0,为放热反应,采用500℃的温度,不利于平衡向正方向移动,主要是考虑催化剂的活性和反应速率,不能用平衡移动原理解释,故B正确;
C.可以可逆反应2NO2(g)?N2O4(g),正反应为体积缩小的反应,加压后二氧化氮的浓度增大,所以气体有色加深,由于增大了压强,平衡向生成四氧化二氮的方向移动,故加压后颜色先变深后变浅,可以平衡移动原理解释,故C错误;
D.氯水中存在化学平衡Cl2+H2O?HCl+HClO,光照使氯水中的次氯酸分解,次氯酸浓度减小,使得平衡向右移动,氢离子浓度变大,溶液的PH值减小,能用勒夏特列原理解释,故D错误;
故选B.
点评 本题考查了勒夏特列原理的使用条件,题目难度不大,注意使用勒夏特列原理的前提必须是可逆反应,且符合平衡移动的原理,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
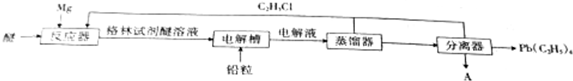
 ,电解物质A的化学方程式为MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
,电解物质A的化学方程式为MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘升华时破坏了共价键 | |
| B. | PH3沸点低于NH3沸点,因为P-H键键能低 | |
| C. | HF的分子间作用力(含有氢键)大于HCl,故HF比HCl更稳定 | |
| D. | 氯化钠固体中的离子键在溶于水时被破坏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷分子的球棍模型: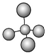 | B. | NH4Br的电子式: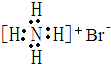 | ||
| C. | 34S2-的结构示意图: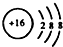 | D. | 邻羟基甲苯酸的结构简式: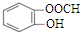 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 现象 | 离子方程式 | |
| A | 向淀粉KI溶液中滴加硫酸氢钠溶液 | 在空气中放置一段时间后,溶液呈蓝色 | 4H++4I-+O2═2I2+2H2O |
| B | 将氯水滴加到含KSCN溶液的绿矾溶液中 | 溶液由浅绿色变为红色 | 2Fe2++Cl2═2Fe3++2Cl-, Fe3++3SCN-═Fe(SCN)3 |
| C | 向硫化钠和亚硫酸钠的混合液中滴加稀盐酸 | 产生淡黄色沉淀 | 2S2-+SO32-+6H+═3S↓+3H2O |
| D | 向含酚酞的氢氧化钡溶液中滴加稀硫酸 | 有白色沉淀生成,溶液由红色变为无色 | Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
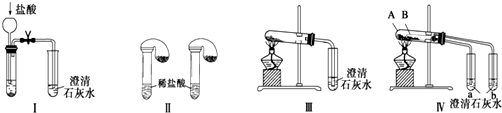
| A. | 根据图Ⅰ所示实验,可以根据澄清石灰水是否变浑浊鉴别碳酸钠和碳酸氢钠固体 | |
| B. | 在图Ⅱ所示实验的左右两只试管中加入足量的盐酸,然后向两个气球中分别加入等物质的量的碳酸钠和碳酸氢钠固体,根据反应后气球的大小可鉴别两种固体 | |
| C. | 与实验Ⅲ相比,实验Ⅳ的突出优点是可以做到用一套装置同时进行两个对比实验,而Ⅲ不行 | |
| D. | 若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则小试管B中装入的固体是碳酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4L | B. | 8L | C. | 10L | D. | 12L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
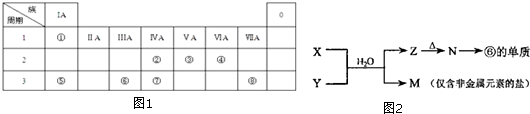
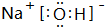 ;
;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com