
【题目】共价键都有键能之说,键能是指拆开1mol共价键所需要吸收的能量。如H-H键的键能是436kJ/mol,H—Cl键的键能是431kJ/mol,Cl—Cl键的键能是247 kJ /mol,H2和Cl2反应生成1molHCl放出的热量是( )
A.431kJB.179kJC.89.5kJD.以上说法都不对
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究 SO2 气体还原 Fe3+,他们使用的药品和装置如图所示,下列说法不合理的是( )

A.为了验证 A 中发生了氧化还原反应,加入KMnO4溶液,紫红色褪去
B.为了验证 A 中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀
C.能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
D.装置C的作用是吸收SO2尾气,防止污染空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述正确的是( )
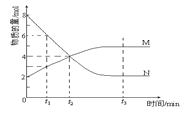
A.反应的化学方程式:2M![]() N
N
B.t2时,正、逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时N的浓度是M浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中, M棒变细,N棒变粗.由此判断下表中所列M、N、R物质,其中合理的是( )

M | N | R | |
A | 锌 | 铜 | 稀硫酸 |
B | 铜 | 铁 | 稀盐酸 |
C | 铁 | 铜 | 硝酸银 |
D | 铜 | 铁 | 氯化铁 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5mL稀盐酸。
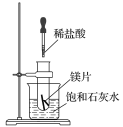
回答下列问题:
(1)实验中观察到的现象是________________。
(2)产生上述现象的原因是________________。
(3)写出有关反应的离子方程式____________。
(4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)在上面元素周期表中全部是金属元素的区域为___。
A.a B.b C.c D.d
(2)G元素与E元素形成的化合物的化学式是___、___,它们都是___。(填“共价化合物”或“离子化合物”)。表格中九种元素的最高价氧化物对应的水化物中,碱性最强的是___(用化合物的化学式表示,下同),酸性最强的是___,属于两性氢氧化物的是___。
(3)①用元素符号将铁元素填写在上面元素周期表中对应的位置___。
②G、H两元素相比较,金属性较强的是___(填名称),可以验证该结论的实验是___。(填编号)
(a)看哪种原子失去的电子越多,金属性越强。
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3、SiO2、Fe2O3)是提取氧化铝的原料。提取氧化铝的工艺流程如下:

(1)滤液甲的主要成分是(写化学式___________________________________________。
(2)写出反应Ⅱ的离子方程式:______________________________________________。
(3)结合反应Ⅱ,判断下列微粒结合质子(H+)的能力,由强到弱的顺序是__________(填字母)。
A.AlO![]() B.OH- C.SiO
B.OH- C.SiO![]()
(4)取滤液甲少许,加入过量盐酸,过滤;再用惰性电极电解其滤液,两极均有气体产生,且全部逸出,在阴极区还有沉淀生成,最后沉淀消失。沉淀消失的原因可用离子方程式表示为________________________________________________________________________。
(5)取(4)电解以后的溶液10.0 mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100 mol·L-1盐酸溶液,当加入50.0 mL盐酸溶液时,生成的沉淀恰好溶解。
加入50.0 mL盐酸溶液发生的离子反应的先后顺序依次为:____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,m g气体A与n g气体B的分子数目一样多,下列说法不正确的是( )
A. 在任意条件下,若两种分子保持原组成,则其相对分子质量之比为m∶n
B. 25 ℃、1.25×105 Pa时,两气体的密度之比为n∶m
C. 同质量的A、B在非标准状况下,其分子数之比为n∶m
D. 相同状况下,同体积的气体A与B的质量之比为m∶n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用平衡移动原理解释的是
A. 用排饱和食盐水的方法收集氯气
B. SO2催化氧化制SO3的过程中使用过量的氧气,以提高二氧化硫的转化率
C. 溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
D. 锌与稀硫酸反应,加入少量硫酸铜反应速率加快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com